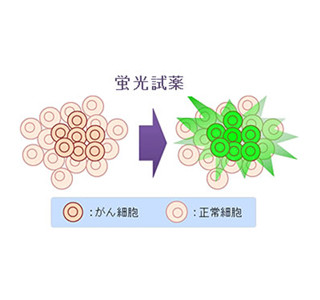
ライブイメージングは、現在の生物学・医学領域における重要技術のひとつとなっている。生体内の細胞の様子を蛍光で可視化するというこの技術を支える物質が、蛍光プローブだ。蛍光プローブは、特定の物質と反応すると分子構造が変化し、強い蛍光を発するようになるため、がん細胞のみを選択的に発光させたり、生体分子を可視化したりすることが可能となる。
そもそも物質が発する蛍光を制御すること自体、難しい。思いどおりに蛍光プローブを合成しようとなると、もはや至難の業である。しかし、東京大学大学院薬学系研究科/医学系研究科 浦野泰照教授は、分子内スピロ環化という独創的なアイディアをもとに、数々の蛍光プローブ分子を開発してきた。
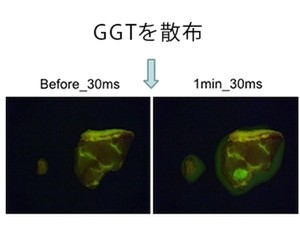
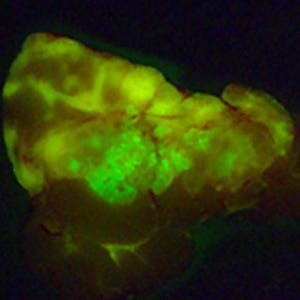
浦野教授が開発した蛍光プローブのうち、すでに30種類以上が国内外で市販され、世界の生物学・医学研究に大きく貢献している。さらには、臨床の現場で使える蛍光プローブの開発をも手がけ、微小がん部位を手術中に可視化できるスプレープローブ技術の実用化を目指し、研究を進めている。
浦野教授はこれらの業績が評価され、第17回(2017年度)山﨑貞一賞を受賞した。本稿では、山﨑貞一賞の受賞理由となった、分子内スピロ環化に基づく蛍光プローブの開発と医学領域への応用について、前後編にわたり詳しくお話を伺った。
■浦野泰照氏 プロフィール
「分子内スピロ環化」で蛍光プローブを設計する
――浦野先生はこれまでに、数多くの蛍光プローブの開発を進められてきました。特定の物質と反応させたときに蛍光を発するという蛍光プローブの機能は、どのようにして実現するのでしょうか。
色鉛筆は多いもので数百色ありますが、蛍光ペンは数色程度しかありませんよね。このように、蛍光性の物質自体がごく稀にしか存在しないということもあり、特定の物質と反応して蛍光を発するような物質を狙って合成するということは、非常に難しいといえます。
そこで私たちは、もともと蛍光性を持っている化合物の構造を人為的に少しだけ変えて蛍光を消し、特定の物質にだけ反応してもとの蛍光性物質の形に回復するような化合物を作るというアイディアで研究を行ってきました。
――どのようにもとの蛍光性物質の構造を変えるのでしょうか。
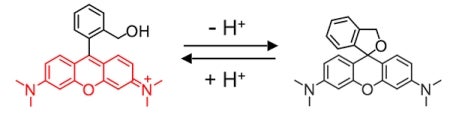
「分子内スピロ環化」という化学反応を利用しています。蛍光性物質として、ローダミンという化合物がよく知られていますが、私たちは、このローダミン分子の蛍光を消すためにスピロ環化状態を分子内で作り、ある特定の物質に反応するとこのスピロ環が開いて蛍光を発するもとのローダミンに戻るような仕組みを考えました。
――分子内スピロ環化について詳しく教えてください。
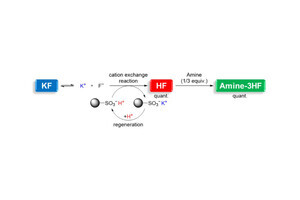
分子内スピロ環化は、Michael付加という化学反応をうまく利用して、分子内に環状構造を作る反応です。私たちは、pH 15付近という強塩基性環境下で、ある種のローダミンに水酸化物イオンがMichael付加して、蛍光を消すことが出来ることを見つけましたが、残念ながらpH 7.4という私たちの体内の環境でこの原理を使うことはできません。
そこで私たちは、Michael反応を分子内で起こすということを考えました。上記の構造式で表されるローダミンのカルボキシル基(-COOH)をヒドロキシメチル基(-CH2OH)に変えると、分子内でMichael反応が起き、新たな環状構造を持つようになります。このスピロ環化後の化合物には、色も蛍光もありません。
実をいうとこの化合物は、偶然に見つかったものなんです。通常このような反応は、pHの高い強塩基性環境でしか起きないと考えられるのですが、この反応は不思議なことにpH 9.5で起きます。他の目的でこのローダミンを使った実験を行っていた大学院生が、「pH 10前後でローダミンの色が消えてしまうのですが、なせでしょうか」と相談してきたことがきっかけで、このようなスピロ環化反応が起きていることに気づきました。pH 9.5という弱い塩基性環境下で蛍光が消えるのだとしたら、少し工夫すれば体内と同じpH 7.4という環境でもこのような化合物を作れるのではないかと考えました。
――偶然見つかった化合物がきっかけとなって、分子内スピロ環化を利用した蛍光プローブを作るという研究を進めることになったんですね。
たとえば、私たちが開発したスピロ環に硫黄元素(S)が含まれる蛍光プローブは、最初は無色・無蛍光ですが、次亜塩素酸(HOCl)に選択的に反応して、色と蛍光を持つ物質に変わります。したがって、この蛍光プローブを細胞内に入れておくと、次亜塩素酸が生成された際に蛍光が確認できるはずです。
好中球という白血球の一種のなかにこの蛍光プローブを入れると、通常の状態では蛍光は見えませんが、異物を加えた状態では好中球がその異物を分解するために次亜塩素酸を産生し、これに蛍光プローブが反応して蛍光が観察できるようになります。このように、蛍光プローブを使うことで好中球が細胞内でどのような動きをしているのかわかるようになるのです。
――このほかにも、分子内スピロ環化のアイディアをもとに、さまざまな蛍光プローブを開発されてきました。蛍光プローブは、蛍光で可視化したい物質を先に決めてから設計されているのですか?
ごく初期のころは、合成した化合物ありきで、どの物質のプローブとして使えるかという考え方で開発していました。しかしそれでは、化学的にはおもしろくても、広く使ってもらえるプローブにはなりえません。プローブは使ってもらってはじめて価値があるものになります。生物学者やメディカルドクターなどが実際の現場で利用できるようなプローブを設計したほうが、圧倒的なユーザーを確保できますので、最近開発しているプローブのほとんどは、先に目的が決まっています。
(後編に続く)