ライブイメージングは、現在の生物学・医学領域における重要技術のひとつとなっている。生体内の細胞の様子を蛍光で可視化するというこの技術を支える物質が、蛍光プローブだ。蛍光プローブは、特定の物質と反応すると分子構造が変化し、強い蛍光を発するようになるため、がん細胞のみを選択的に発光させたり、生体分子を可視化したりすることが可能となる。
そもそも物質が発する蛍光を制御すること自体、難しい。思いどおりに蛍光プローブを合成しようとなると、もはや至難の業である。しかし、東京大学大学院薬学系研究科/医学系研究科 浦野泰照教授は、分子内スピロ環化という独創的なアイディアをもとに、数々の蛍光プローブ分子を開発してきた。
浦野教授が開発した蛍光プローブのうち、すでに30種類以上が国内外で市販され、世界の生物学・医学研究に大きく貢献している。さらには、臨床の現場で使える蛍光プローブの開発をも手がけ、微小がん部位を手術中に可視化できるスプレープローブ技術の実用化を目指し、研究を進めている。
浦野教授はこれらの業績が評価され、第17回(2017年度)山﨑貞一賞を受賞した。前編では、蛍光プローブの設計について解説いただいたが、後編では蛍光プローブによるがん細胞のイメージングなど、医学領域での展開について詳しくお話を伺った。
(前編はコチラ)
■浦野泰照氏 プロフィール
スプレーでプローブを吹きかけるとがんが光る!
――これまで50種類を超える蛍光プローブを開発され、そのうち実際に30種類以上のプローブ製品が市販化されています。プローブの応用先としてどのようなところがありますか。
細胞のライブイメージングが多いですね。ただし、蛍光プローブは、培養細胞のような2次元的な対象だけでなく、3次元構築した細胞や動物個体などのイメージングにも利用することができますので、私たちの研究室には、有機合成設備や蛍光顕微鏡はもちろん、実験動物やヒトの臨床検体に使える蛍光イメージャーなども揃っています。現在では、細胞のライブイメージングだけではなく、共同研究者のニーズに合わせて、イメージングする対象を選定しています。
――浦野先生が開発された蛍光プローブの応用先のひとつに、微小ながん部位を手術中に可視化できるスプレープローブ技術がありますよね。蛍光プローブによるがん細胞のイメージングについて教えてください。
がんのイメージング手法としては、PETやMRIなどを活用した手法もあります。これらの手法のメリットは、体内の深い部分のがんでも見つけることができる点です。一方で、検出できるがんのサイズはcmオーダーです。最低でも5mm-1cmくらいの大きさのがんでなければ見つけることが難しいという欠点があります。
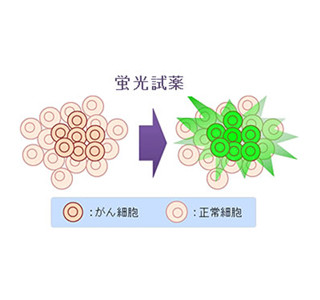
それに対して蛍光プローブは、深い部分が見えないという欠点はありますが、がんの内視鏡検査や外科手術時など目の前に患部がある状態では、プローブをスプレーで散布することで、1mm以下の微小ながんまでも高精細に検出することができます。がん細胞のバイオマーカーと反応して蛍光性物質に変わるプローブがうまくデザインできれば、それを散布することでがん細胞を目に見える形で発光させることができるのです。
――そうなると、さまざまなバイオマーカーに合わせたプローブを作っていくことが必要ですね。
バイオマーカーと一口に言ってもいろいろありますが、なかでも我々は酵素に着目しています。酵素であればそれに対応するプローブが作れる可能性が高いということがその理由のひとつです。酵素は、基質の化学構造を変化させて生成物を与えるタンパク質です。この機能をうまく利用すれば、蛍光のON/OFF制御に繋げることができるだろうと考えました。酵素に着目するもうひとつの理由は、ターンオーバーするという特徴を持っていることです。酵素は、基質を生成物に変化させるという反応を何度も起こすため、最終的にかなり明るくがんを染められると考えました。
――具体的にどのような酵素をターゲットとされたのですか。
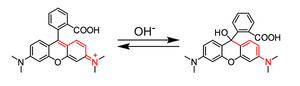
アミド結合を加水分解するペプチターゼという酵素です。そのためにアミノ基(-NH2)を持っているローダミンを利用しました。このローダミンのアミノ基をアミド化(CH3C(=O)NH-)したローダミンは、pH7以上で無色透明となり蛍光も消えます。つまり、この無色のローダミンは、アミド結合を加水分解するような酵素と出会うと、蛍光を発するローダミン分子へと変わります。そして、その蛍光性ローダミン分子を取り込んだ細胞が蛍光を発するようになるというわけです。たとえば、アミド結合を形成するアミノ酸としてアラニンを用いたプローブを設計すると、アラニンを認識して加水分解するアラニンアミノペプチターゼという酵素の活性を確認することができます。
――アミド基を持つローダミンからアミノ酸が切り離されたことをプローブで確認することで、そこに酵素があったと判断するんですね。
文献を調べていくと、なかでもGGT(γ-グルタミルトランスペプチダーゼ)というグルタミン酸を認識して切り離す酵素が、乳がんや卵巣がんなどのがん細胞で活性化しているという報告があったので、これに対するプローブを開発しました。
実は、GGTは細胞膜上に存在しており、さらに酵素のポケットが外側を向いていることがわかっています。酵素反応が細胞の外側で起きているということなので、実はがん細胞に接している正常な細胞には、一細胞レベルでは蛍光生成物が取り込まれる可能性があります。しかし実際の手術では、一細胞レベルでの切除が出来るわけではなく、0.1~1mm程度の精度が限界です。よって、がん細胞の外側でできた蛍光生成物が周辺の細胞の中に入っていって微小がん部位の存在を術者に知らせる、というこのやり方でも十分だと考えています。
――手術中にがんがあると思われる場所に散布して、蛍光を発した部分を切除するという流れでプローブを利用するということですね。
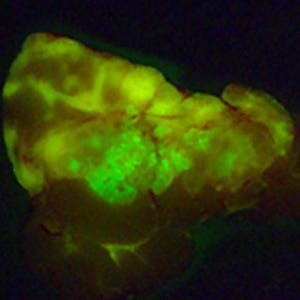
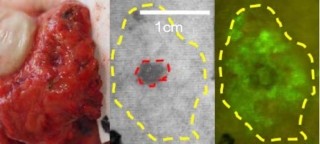
実際に、乳がん患者さんから外科手術で摘出した乳がん組織にこのGGTプローブを散布すると、数分後にはがんだと疑われる箇所が肉眼で見えるほど光ることが実験で確認されています。この速さで乳がんを診断できるのは、このプローブが世界で唯一だと思います。
乳がんの手術では、部分切除を選んだ場合、がんを取り残すリスクがあります。通常、がんの取り残しを避けるために、術中に断端の標本を作り、病理医と外科医がチェックするのですが、病理医は細胞ひとつひとつを確認していくため、疑いのある箇所全体の病理を見ることはできません。私たちのプローブが術中に使えるならば、断端にがんが残っていないということを迅速に確認することができます。そうすることで、がんが再発するリスクをぐっと下げることができると考えています。乳がんについてはこれまで100例以上検証してきましたが、90%程度の確率でがんを光らせることができています。
――90%とは、かなり高く感じます。
ただしGGTプローブであらゆるがんが光るというわけではなく、食道がんについては、このプローブではあまり良い成績が得られませんでした。GGTプローブでうまく光らないがんに対しては、バイオマーカーとなる他の酵素を探しています。良いターゲットとなる酵素を見つけて、それに対するプローブをその都度開発していくことで、さまざまながん種に対応していければと思っています。
――一番実用に近いのは、やはり乳がんの診断ということなのでしょうか。
今のところは乳がんですね。ほかにも、食道がんと膵液漏に対する研究が臨床試験に向けて進んでいるところです。食道がんでは、400種ほどあるジペプチルペプチターゼという酵素群のスクリーニングをしていくことで、プローブのターゲットとなる酵素DPP4(ジペプチルペプチターゼ4)を発見しました。DPP4は糖尿病との関係は知られていましたが、食道がんとの関連性はそれまでほとんど報告されていませんでした。しかし、DPP4のプローブを使うことで、70例程度の検体に対して85~95%程度の確率で食道がんを光らせることができています。