京都大学(京大)は5月24日、RNA分解酵素Regnase-1が鉄代謝に関連する遺伝子のmRNAを分解することで、貧血時に鉄の吸収を促進することを解明したと発表した。
同成果は、京都大学ウイルス・再生医科学研究所 竹内理教授、同医学研究科博士課程 吉永正憲氏らの研究グループによるもので、5月23日付けの米国科学誌「Cell Reports」に掲載された。
体内の鉄の量が不足すると貧血を生じ、逆に過剰になると臓器が機能不全を起こすヘモクロマトーシスといった疾患の原因になる。したがって生物の体内での鉄の量は、さまざまな仕組みにより厳密に調節されており、そのような仕組みのひとつとして、関連する遺伝子のmRNAの安定性を調節する機構が知られている。すでに鉄代謝にかかわるmRNAを安定化する因子は判明しており、研究が進められているが、鉄代謝にかかわるmRNAの分解を促進する機構はほぼ明らかになっていなかった。
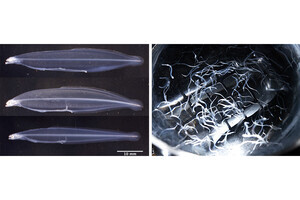
一方、同研究グループはこれまでに、RNA分解酵素であるRegnase-1を発見し、この分子が炎症関連遺伝子のmRNAを分解することで免疫機能を抑制していることを報告してきた。この研究の過程でRegnase-1を欠損したマウスが、炎症性疾患に加え、重度の貧血を発症することを見出しており、Regnase-1が慢性炎症時の貧血発症にかかわる可能性が示唆されていたが、Regnase-1欠損マウスにおいて貧血がどのようにして起こるのかは明らかになっていなかった。
今回の研究では、鉄代謝にかかわるタンパク質のなかでトランスフェリン受容体とPHD3のmRNAをRegnase-1が分解することが明らかになった。Regnase-1はPHD3のmRNAを分解することで、腸での鉄吸収において重要な転写因子であるHIF2αを安定化させ、腸管での鉄吸収を促進しているという。また、Regnase-1自身がHIF2αの標的遺伝子であり、Regnase-1、PHD3、HIF2αの三者からなる正のフィードバック機構が腸管での鉄吸収を調節していることも明らかになった。
同研究グループは、今後ヒトの貧血や鉄代謝異常におけるRegnase-1の役割を検討することで、これら疾患のさらなる病態解明に発展することが期待されると説明している。