京都大学 iPS細胞研究所(CiRA)は2月14日、ヒトiPS細胞から自己複製が可能な「巨核球」を誘導することに成功し、大量に血小板を生産する方法を確立したと発表した。
成果は、CiRAの中村壮 研究員、同・江藤浩之 教授らの研究チームによるもの。研究の詳細な内容は、米国東部時間2月13日付けで米国科学誌「Cell Stem Cell」に掲載された。
血小板は止血に重要な役割を果たす核のない直径2~3μmの血液細胞で、巨核球という細胞から分離することで生み出され、血液の中を循環しながら、止血で利用されるか一定の寿命で崩壊する。自ら分裂することはできないので、常に巨核球から作られ、必要量が補充される仕組みだ。また巨核球そのものは、血液のあらゆる細胞に分化する多分化能と自己複製能を持った「造血幹細胞」から作られる。巨核球は成熟すると核分裂はするが細胞分裂はしないという特殊な分裂を行い、大型で多核の細胞になるという大きな特徴を持つ。
現在、深刻な貧血および出血素因をもたらすような血液疾患の患者は、献血による血液製剤を用いた輸血に頼らざるを得ない状況だ。しかし、献血ドナーの数は少子高齢化などもあり、減少している。厚生労働省の統計によると、2027年には日本の必要な輸血製剤の20%はドナー不足に伴い供給できないと発表されている状況だ。
特に血小板は機能を維持するために室温で保存する必要があり、採血後4日間しか有効期間がない。そのため、必要な時に必要な量の血小板を供給することが困難だ。こうした状況を改善するためには、ドナーに依存しないで血小板などの血液製剤を生産する仕組みが必要である。
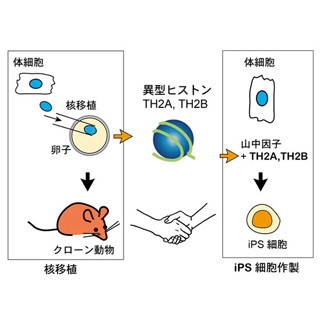
江藤教授らは2010年に皮膚細胞由来のiPS細胞から培養皿上で血小板が生産できることを発表。しかし1回の輸血では患者1人につき2000~3000億個もの血小板が必要だが、これまでの方法では、10億個程度しか生産できないという弱点があった。そこで今回は血小板前駆細胞である巨核球に着目し、長期間にわたって自己複製することができる巨核球の誘導が試みられたというわけだ。
これまでの研究で、iPS細胞作製に必要とされる遺伝子「山中因子」の4つの内の1つ「c-MYC」を働かせることで、血小板の生産量を増やすことができることがわかっていた。今回の研究では、さらに造血幹細胞の細胞分裂に重要な働きをする「BMI1」やアポトーシスを抑制する「BCL-XL」という遺伝子を利用することで、5ヶ月以上自己複製可能な巨核球をiPS細胞から誘導することに成功したのである。
具体的には、iPS/ES細胞から2週間かけて誘導した「造血前駆細胞」(造血幹細胞の子孫細胞)にc-MYCとBMI1を導入し、さらに2~3週間後にBCL-XLを追加で働かせることで、ほぼ無限に複製できる巨核球を作製することに成功したというわけだ(画像1)。
巨核球で強制的に働かせていた3つの遺伝子の働きを止めると、およそ5日後には巨核球が、1つの細胞の中で、2倍・3倍と通常よりも多く染色体が含まれる状態になる「倍数体化」して成熟し、血小板の生産を開始することが確認された(画像2・3)。この方法によって直径10cmの培養皿(10mLの培養液)で巨核球を培養したところ、200~400万個の血小板の作製に成功したという。つまり、25~50Lの培養液を用いれば輸血に必要な1000億個の血小板を5日以内に用意できることになるというわけだ。

|

|
|
倍数体化し成熟した、不死化された細胞株由来の巨核球。3つの遺伝子を発現中(遺伝子誘導中)の巨核球(画像2:左)と遺伝子の発現誘導を止めて成熟させた巨核球(画像3:右)。色はギムザ染色によるもの。図中のバーは50μmを示している |
|
今回の方法で生産した血小板は、血小板を凝集させる機能がある血液凝固因子の1種である「トロンビン」の存在下で凝集するなど(画像4・5)、基本的な血小板の機能を持っていることが判明。ヒトから採血した直後の血小板と比べると反応が弱かったものの、保存した血小板やiPS細胞から直接誘導する方法で作成した血小板と比較すると強い反応を示すことも確認されている。従って、今回の方法で生産した血小板は十分に機能すると考えられるという。

|

|
|
トロンビン添加で凝集した血小板。画像4(左):古い血小板。画像5(右):iPS細胞から誘導した巨核球 |
|
従来のiPS細胞から血小板を生産する方法では、輸血に必要な1000億個もの血小板を生産するためにはヒトiPS細胞が70億個程度必要で、最終的に血小板を得るまでに26日程度必要だった。しかし今回の方法では、250億個の自己複製する巨核球前駆細胞を使用して5日で血小板を得ることが可能だ。
また培養する装置も、実験室レベルのシャーレ(10mL)からバッグ(1~500L)にすることで複雑な設備を使わずに大量に培養することができる。このシステムにより、日本人に多いHLA型のiPS細胞から血小板製剤を生産するための巨核球のストックや、ドナーが見つかりにくいHLA型やそのほかの特殊な血小板型(HPA型)の患者への血小板製剤の安定供給が可能となるという。このシステムを用いた臨床研究が平成27~28年に計画されており、最終的には臨床試験を経て10年後の実用化を目指しているとした。