慶應義塾大学(慶応大)と理化学研究所(理研)は1月14日、中枢神経系の神経細胞や「グリア細胞」を生み出す元になる「神経幹細胞」の分化能が、特定の「miRNA(microRNA:小分子RNA)」によって制御されていることを明らかにしたと共同で発表した。
成果は、慶応大 医学部生理学教室の岡野栄之 教授、同・島崎琢也専任講師、理研 統合生命医化学研究センター 免疫転写制御研究チーム 幹細胞制御研究 YCIラボの金田勇人 上級研究員らの共同研究チームによるもの。研究の詳細な内容は、1月13日付けで米科学雑誌「米科学アカデミー紀要(PNAS)」オンライン速報版に掲載された。
神経変性疾患を含む中枢神経系の傷害の効果的な治療法の開発は、超高齢社会に突入した日本などにおいては認知症患者の増加などにより重要な社会的課題となっている。その抜本的解決策として幹細胞を用いた薬剤開発や再生医療が期待されているが、幹細胞から特定の細胞を均質に、効率的に得るのはいまだ困難で、幹細胞を制御する分子メカニズムの解明が急務とされているところだ。
中枢神経系を構成する細胞の元となる神経幹細胞は、発生段階で時期・領域に合わせて性質を変化させ、特定の神経系細胞を生み出すことで複雑な神経ネットワークを形成する機能を持つ。特に、「投射型ニューロン」を含む神経細胞を多く生み出す発生初期型から、主にグリア細胞を生み出す発生後期型への時間経過に伴う性質の変化は、複雑な制御機構のため未解明な部分が多く残されている状況だ。
なおグリア細胞(単にグリアと呼ぶこともある)とは、神経細胞(ニューロン)以外の神経系を構成する細胞の総称で、神経細胞の支持のほか、髄鞘形成、神経栄養因子の合成など、さまざまな重要な役割を担う。また、最近では神経活動への直接的関与も示唆されている重要な細胞だ。
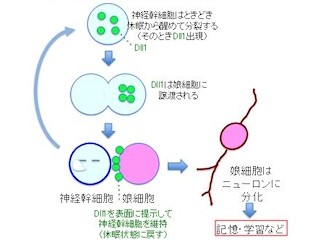
研究チームは以前、神経幹細胞におけるニューロン対グリアの細胞運命が決定する前段階として、転写制御因子「COUP-TFI」と同「II」の発現によってグリア分化誘導シグナルに応答できるようになるための「コンピテンシーの変化」が必要であることを解明している。ただし、その分子メカニズムはわかっていなかった。
コンピテンシーの変化についてもう少し詳しく触れると、狭義には「シグナル応答能の変化」ともとらえられているが、そこに反映される細胞の包括的な性質の変化を含む形だ。今回の研究においては、主にグリア分化誘導シグナルへの応答性の変化に伴う神経幹細胞の性質の変化が指し示されている。
そこでまず、COUP-TFの発現を抑制して、グリア新生を阻害した神経幹細胞において発現量が変化する遺伝子群の機能が調べられた。その結果、複数のmiRNAで構成されている「miR-17-92」クラスターの内、「miR-17」(と高い相同性および同一のシード配列を有する2つのパラログ(遺伝子重複によって生じた2つの遺伝子のこと)である「miR-106a」および同「b」)が、グリア新生を阻害する因子であることが判明したのである。さらに、発生段階が進んでグリア新生期となり減衰した神経幹細胞の神経産生能を、それらの強制発現によって回復させることができることも判明(画像)。
また、miR-17は標的遺伝子として「p38MAPキナーゼ」の発現を抑制し、p38MAPキナーゼの発生初期における神経幹細胞への強制発現はグリア新生を早めることが明らかとなった。これらのことから、miR-17とp38MAPキナーゼの発現量の変化によってコンピテンシーが変化し、神経新生期からグリア新生期へと移行していると考えられる。
下の画像が、それをまとめた概念図だ。miR-17/106とp38MAPキナーゼの発現量のバランスで、神経幹細胞のコンピテンシーが制御され、神経新生型からグリア新生型へと変遷し、miR-17の強制発現によって神経産生能が回復するというわけだ。
このように特定のmiRNAの発現量によって神経幹細胞のコンピテンシーが制御されており、その量を調節することによって分化能を制御できることがわかった。これは、新しい幹細胞制御法につながる画期的な発見であると考えるという。
なおmiRNAとは、長さ20~25塩基ほどの短いRNAのこと。miRNAが複数連なりクラスターを形成している場合もある。miRNAはターゲットのタンパク質をコードするメッセンジャーRNA(mRNA)に結合し、その分解を促進したり、タンパク質への翻訳を阻害したりする機能を持つことから、がんや病気などを含む、さまざまな生命現象に関わることが判明済みだ。
今回発見したコンピテンシーの制御法は、神経幹細胞だけでなくほかのさまざまな細胞でも応用可能だと考えられるという。実際にmiR-17はほかのさまざまな幹細胞でも発現が見られ、分化制御に関与している報告もあるとする。今後、さまざまなmiRNAとさまざまな幹細胞のコンピテンシーの関係性を包括的に解明し、薬剤開発・再生医療・がん治療などに応用可能な細胞制御技術の開発につながることが期待されるとした。