立教大学は6月14日、ポストゲノム情報を駆使して、「原始紅藻シゾン(Cyanidioschyzon merolae)」の細胞小器官「ペルオキシソーム(マイクロボディ)」の分裂に必須なリング状の分裂装置を発見して単離に成功し、「c-Pod(Cyanidioschyzon Peroxisome dividing)リング」と命名、さらにそれが2重のリングから構成される超分子ナノマシンであること、その主たる構成タンパク質の遺伝子は高等動植物にも普遍的に保存されていることを明らかにしたと発表した。
成果は、立教大学理学部の井元祐太特別研究員(東京大学 JSPS特別研究員・新領域河野研究室)、同・黒岩常祥特定課題研究員らのチーム(黒岩晴子博士、大沼みお博士)らの研究チームによるもの。研究の詳細な内容は、6月4日付けで米科学雑誌「米科学アカデミー紀要(PNAS)」に掲載された。
ペルオキシソームは、生物の3大栄養素(糖・脂肪・タンパク質)の1つである脂質代謝(脂肪・油脂、ステロイドなど)や有害な活性酸素の除去、脳の神経細胞膜を構成する「プラズマローゲン」の合成を行うなど、生命(細胞)の生存に必須の、DNAを含まない単膜に包まれた細胞小器官(オルガネラ)の1つだ。
ヒトにおいてはその形成・増殖の障害があると、II型糖尿病に始まり、致死的疾患の「Zellweger症候群」を含むペルオキシソーム病などの先天性代謝異常症(脂肪代謝障害、脳・中枢神経の形成と発達不全などの臨床症状)、アルツハイマー病などを引き起こすとして知られている。
しかし発見されてから約半世紀になるが、その誕生や形成・増殖の仕組みは、複数の説が唱えられているが、実際のところはまだよくわかっていない。その原因とされているのが、ヒトなど高等動植物の細胞では、1個の細胞当たり、細胞核1つに対してペルオキシソームが数100から数1000もあり(画像1)、しかもそれらがランダムに増えるため(画像2)、その細胞内での動態が完全につかめないことが大きかったのである。
その問題を克服するため、今回の研究では最もシンプルな真核生物のシゾンが使われた。シゾンは500分の1mmと小さく、1回の細胞分裂が1生活環という特徴の生物だ。さらに、ヒトやイネなどの真核細胞が含む7種すべての細胞小器官を含み、その数はペルオキシソームを含めほとんど1個とシンプルである(画像2・下)。

|

|
|
画像1。高等動物や高等植物はペルオキシソーム(画像中の赤い細胞小器官)は多量に存在する |
画像2。ヒトとシゾンの1細胞のペルオキシソームを示す蛍光顕微鏡写真と、シゾンのペルオキシソームの拡大像と細胞構造のモデル |
シゾンは葉緑体を1個含んでいるため、これが光のセンサとなり、光の明暗で細胞分裂を容易に同調化することが可能だ。これは動物細胞ではできない。シゾンの細胞分裂と共に細胞に含まれる7種の細胞小器官も順次に同調的に分裂し、ペルオキシソームに大量に含まれる「カタラーゼ」をマーカーとした「免疫蛍光顕微鏡法」による観察から、ペルオキシソームは葉緑体、ミトコンドリアの分裂に続いて細胞核と共に細胞分裂期の最後に分裂することがわかった(画像3・4)。

|

|
|
画像3。シゾンの細胞周期および、細胞小器官の分裂周期 |
画像4。ペルオキシソームの無傷単離前後の位相差免疫蛍光顕微鏡写真。ミトコンドリア(黄)と、ペルオキシソーム(赤)、葉緑体(位相差像)とペルオキシソームの拡大像 |
しかし、その分裂時間が短期間だったため、光の明暗による同調だけでは分裂中のペルオキシソームを十分に観察して、大量に集めることができなかったという。そこで細胞の分裂を阻害する薬剤(オリザリン)で処理し、通常の20倍の数に分裂しているペルオキシソームを含む細胞を得るという手法が採用された。この系を用いて、単離された大量に無傷な分裂期ペルオキシソームが、画像5である。
そして、画像5の単離画分を高精度の「マトリクス支援レーザー脱離イオン化飛行時間型質量分析装置(Matrix-Assisted Laser Desorption/Ionization Time-of-Flight Mass Spectrometry:MALDI-TOF MS)」を用いた「ディファレンシャルプロテオミクス(全タンパク質分析)」によって解析し、分裂期のペルオキシソームにのみ含まれる13種類のタンパク質が同定された(画像6)。
解析した13種のタンパク質群の内最も量が多かった1つが、「ダイナミン(Dnm1)」だ。これまでの研究から、シゾンには2種類のダイナミンがあり、すでにDnm1はミトコンドリアの分裂装置として、Dnm2は葉緑体の分裂装置として使われていることはわかっていた。よって、「Dnm1はミトコンドリアの分裂に使われた後、ペルオキシソームの分裂にも使われる」という仮説が導き出されたのである。
次にその仮説を確認するため、免疫蛍光顕微鏡法でDnm1の動態が調べられた。そして、Dnm1は分裂面でミトコンドリアの分裂を遂行した後、一度細胞質に移行してから、次にペルオキシソームの分裂面でリングを形成し、今度はペルオキシソームの分裂に参加していることが判明。単離したペルオキシソームの分裂面にはダイナミンDnm1が局在していた(画像7(A))。
そこで、この微細構造を免疫電子顕微鏡法で調べるとDnm1を含むリング状の構造が分裂面に現れた(画像8(B))。Dnm1はリングの外周上に局在していた(画像9(C))。リングは直径最大で約500nmから、最少で50nmにまで収縮する分裂装置であることがわかったのである。そして、ペルオキシソーム分裂装置、c-Podリングと命名されたというわけだ。

|

|

|
|
画像7(左):単離したペルオキシソームの分裂面に局在するダイナミン。ダイナミン(Dnm1、黄緑)、ペルオキシソーム(Po、カタラーゼ、赤)画像8(中):c-Podリングの免疫電子顕微鏡写真。ダイナミンDnm1(15nmの金粒子)、カタラーゼ(10nm の金粒子)。ダイナミンリングははがれ易い。画像9(右):c-Podリングの免疫電子顕微鏡写真の拡大画像 |
||
次にc-Podリングをさらに強力な界面活性剤で処理することで、純化が行われ、取り出された。c-Podリングは、直径が平均250nm程の小さなリングで(画像10・上)、Dnm1が均一にリング状に局在していることがわかる(画像10・下)。これらの事実より、発見された当初はc-PodリングDnm1を主成分とすると考えられた。しかし、ダイナミンを活動させるために必要なGTPを添加しても、リングを収縮させることはできなかったのである。
そこで免疫電子顕微鏡法で純化したc-Podリングの微細構造の観察が行われた、すると、c-PodリングはDnm1を含む外側のDB(Dynamin-based)-リングと、内側のダイナミンを含まない幅5nmのナノフィラメント束からなるF(Filamentous)-リングの2重構造であることが明らかになった(画像11)。さらにc-Podリングの収縮過程においてF-リングは、分解されながら収縮することも判明したのである。
収縮後、最後にペルオキシソーム膜を分断する過程においては、DBリングのみが観察され、ミトコンドリアと同様にDnm1がペルオキシソーム膜を直接分断していることが示唆された。Dnm1遺伝子の発現を抑えるとDB-リングは形成されず、ペルオキシソーム分裂面の収縮は起こらないことが判明。以上の結果から、ペルオキシソームはc-PodリングによるDB-リングとF-リングによる収縮、とそれに続くDnm1による膜の分断、という2段階の分子機構で分裂することが明らかにされたのである(画像12)。

|

|

|
|
c-Podリングの構造と分子機構。画像10(左):Dnm1で染色したc-Podリングの位相差(上)、および免疫蛍光顕微鏡写真(下)。画像11(中):c-Podリングの電子顕微鏡写真。画像12(右):c-Podリングによるペルオキシソーム分裂の仕組みのモデル |
||
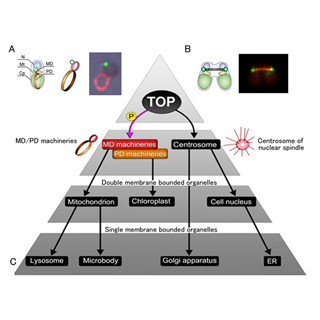
最後に、c-Podリングとこれまで見つかっているミトコンドリアと葉緑体の分裂装置の比較がなされたところ、c-Podリングに含まれていたDnm1が、ミトコンドリアの分裂装置「MD-リング」に含まれているものとまったく同じタンパク質であることがわかった(画像13)。こうした結果は、c-PodリングがMD-リングの構造を基に作られた可能性を示唆しているという。
ヒトの細胞の祖先でもある宿主真核生物は、20億年前に細菌であるパラサイト(細胞内共生したα-プロテオバクテリア)の分裂増殖をコントロールするためにMD-リングを獲得したと考えられ、また重要な酵素のいくつかはペルオキシソームの基質とミトコンドリアの内外膜間、および基質に共通に存在していることから、ある時点で、Dnm1を含むMD-リングによる分裂によってミトコンドリア外膜の一部が分裂し、ペルオキシソームが誕生したと推定されるとした(画像14)。
その後、ミトコンドリアでは酸素と糖からエネルギーを作るようになり、ペルオキシソームでは、脂肪酸代謝を行うと共に活性酸素を水と酸素に分解する。ヒトの細胞の祖先は、このようにペルオキシソームをミトコンドリアの姉妹器官として獲得し、さらにエネルギー代謝機能を2つの細胞小器官に分担させるように適応進化したと考えられるという。これまで、二重膜系細胞小器官であるミトコンドリアと葉緑体の誕生と進化については研究が進められていたが、今回の研究により、はじめて単膜系細胞小器官誕生の謎の解明に迫る具体的な証拠が明らかされたといえるとした。
そして研究チームは、今後の展開と応用として以下の3つを挙げた。まず1つ目は、今回、ペルオキシソームがミトコンドリアの姉妹として誕生したことが示唆されたことから、同様にほかの単膜系細胞小器官(ゴルジ体、小胞体、ライソゾーム)においてもその分裂機構を明らかにすることで、それらの誕生と進化の仕組みが解明されることが期待されるとする。
2つ目は、分裂装置が二重膜系(ミトコンドリアと葉緑体)のみならず、単膜系のペルオキシソームでも見つかったことから、今後ほかの単膜系細胞小器官(ゴルジ体、小胞体、ライソゾーム)においても同様の分裂装置、および増殖の仕組みが、MALDI-TOF MSを用いたプロテオーム解析により明らかにされることが期待されるという。
そして3つ目は、c-Podに含まれていた、いくつかのタンパク質の高等動物における欠損はペルオキシソームの分裂障害や、致死性の重篤な疾患を引き起こす原因になることが知られているため、今回の研究の知見は医療への応用が期待されるとした。
また、c-Podリングに類似の分化した装置が脳の神経伝達に関わる小胞形成に使われていることが示唆されており、脳の神経伝達の機構やアルツハイマー病などの病気仕組みの解明にも応用されることが期待されるという。さらに、ペルオキシソームは油脂やコレステロールなどの代謝にも重要な役割を担うため、有用物質生産への応用も期待されるとした。