科学技術振興機構(JST)は5月14日、東京大学との共同研究により、マウスとヒトのiPS細胞から血液の基になる「造血幹細胞」をマウス体内で作り出すことに成功し、この方法を応用して遺伝性の血液疾患マウスの遺伝子治療にも成功したと発表した。
成果は、東大 医科学研究所の中内啓光教授らの研究チームによるもの。研究はJST課題達成型基礎研究の一環として行われ、詳細な内容は米国東部時間5月14日付けで米国遺伝子治療学会誌「Molecular Therapy」オンライン版に掲載された。
白血病やそのほかの血液疾患では、現在のところは、骨髄、つまりは造血幹細胞の移植が有効な治療手段となっている。造血幹細胞とは、リンパ球や赤血球、白血球など、血液細胞の基本となる幹細胞のことをいう。成体では主に骨髄に存在し、すべての血球系細胞に分化することができる多能性幹細胞の1つだ。この造血幹細胞を移植できれば問題はないわけだが、慢性的なドナー不足という深刻な問題を抱えているのは、多くの人がご存じのことだろう。
そこで近年になって、新たな移植ソースとして注目されるようになってきたのが、iPS細胞だ。しかし、そのiPS細胞もまだまだ実用面での問題を抱えており、試験管内において、造血幹細胞に分化誘導するのが難しいのが現状である。その理由は、iPS細胞を目的の細胞に分化させるには、特定の栄養素や環境因子などの条件を整える必要があるのだが、造血幹細胞に分化させるにはそれらがまだ明確にはわかっていないからだ(誘導するための条件がわかった細胞はまだ少ない)。
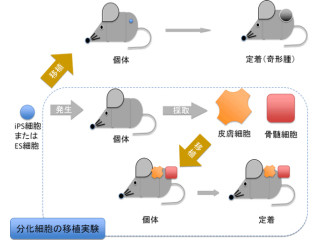
そこで中内教授らは今回の研究で大胆な発想を行い、iPS細胞を造血幹細胞に分化させる場所として「テラトーマ」という良性腫瘍に着目することにした。テラトーマは、ES細胞やiPS細胞をマウスに移植した際に得られる腫瘍のことで、血液細胞を含むさまざまな組織へ分化した細胞が含まれていることは確認されている。
従って、iPS細胞を用いてテラトーマを作製する過程で造血幹細胞の維持に必要とされるタンパク質の「サイトカイン」や造血を支持する細胞を投与することで、テラトーマ内に効率よく造血幹細胞を誘導できるのではないかと考えたというわけだ。
そしてもう1つの仮定は、もしテラトーマの中で造血幹細胞が誘導されたとしたら、テラトーマの中にとどまらず、骨髄に移動するだろうというものである。骨髄移植の場合、末梢血に注入された造血幹細胞は骨髄に移動して造血を開始する性質を持つ。そこでテラトーマができたマウスの骨髄を詳しく探せばiPS細胞由来の造血幹細胞が見つかるだろうと推察し、中内教授らは今回の研究を進めたのである。
まず、マウスのiPS細胞から機能的な造血幹細胞が誘導されるかどうかを検討するために、緑色蛍光タンパク質GFP(Green fluorescent protein)の遺伝子を持つマウスからiPS細胞を樹立し、緑色蛍光タンパク質の遺伝子を持たないマウスの皮下にサイトカインと支持細胞と共に注入し、テラトーマが作製された。これは、iPS細胞から分化した細胞を蛍光色で識別できるようにするためである。その結果、iPS細胞を注入しテラトーマが形成されたマウスの末梢血中に、iPS細胞由来であることを示す緑色の血液細胞が検出された(画像1)。
また、生体内の造血幹細胞は骨髄に集まる特性を持つため、骨髄中を調べるとiPS細胞由来の造血幹細胞が検出され、さらにテラトーマ中にはiPS細胞由来の血液細胞が存在していることも判明。この造血幹細胞を採取し、放射線照射によって造血幹細胞を破壊したマウスに移植した結果、移植後長期にわたってマウスの体内にiPS細胞由来の血液細胞が生着しており、すべての血球系へ分化していることが確認されたのである(画像2・3)。以上の結果から、iPS細胞由来の造血幹細胞は長期にわたって造血能を保持した機能的な細胞であることが示唆された。
|
|
|
|
iPS細胞からの造血幹細胞の誘導方法画像2(左):iPS細胞をマウスに注入するとテラトーマが形成されその中で造血幹細胞が分化し、骨髄に移動する様子。画像3(右):iPS細胞は「OP9」という支持細胞と共にマウスに注入し、サイトカインはポンプに入れてマウスの皮下に埋め込む。3カ月後、骨髄からiPS細胞由来の造血幹細胞を取り出し、造血幹細胞を失ったマウスに移植すると生着して造血する |
|
次に、iPS細胞からの造血幹細胞誘導法の応用例として遺伝性の血液疾患である免疫不全症マウスからiPS細胞を樹立し、正常遺伝子を導入してから造血幹細胞を誘導することにより、マウスの免疫不全症の治療モデルを構築。「共通γ鎖遺伝子」を欠損したためにリンパ球がなく、「重症免疫不全症(X-SCID)」を発症するマウスからiPS細胞を樹立し、そこに欠損した遺伝子を導入して遺伝子治療が施された。そして、この治療されたiPS細胞を再び免疫不全マウスの皮下に支持細胞と共に注入し、テラトーマが作製されたのである。
その結果、テラトーマが形成された免疫不全マウスの末梢血中にiPS細胞由来のリンパ球が検出された(画像3)。このことから、遺伝子治療を施したiPS細胞からテラトーマ形成を利用して、誘導した造血幹細胞を自家移植することにより、免疫不全症などの血液疾患を根治的に治療できる可能性が示唆されたのである。
ヒトへの応用の可能性をさらに検討するため、上記の実験系を用いてヒトのiPS細胞からも造血幹細胞を誘導できるかどうかが検討された。もしこれが可能であれば、前述したように免疫不全症の治療の際に、遺伝子治療した自分自身の造血幹細胞を使って移植ができることになる。また白血病などの治療の際も、骨髄バンクを利用せずに自分自身の造血幹細胞で移植を行うことが可能になるというわけだ。
そこで、ヒトiPS細胞をサイトカインと支持細胞と共にマウスの皮下に注入した上で、末梢血と骨髄の解析が行われた。その結果、テラトーマが形成されたマウスの骨髄中にヒトの造血幹細胞が検出されたのである。
このようにして得られたヒトの造血幹細胞を採取して、別の造血幹細胞を破壊したマウスに移植した結果、骨髄への生着およびすべての血球系に分化していることが確認された(画像4)。以上の結果は、テラトーマ形成を介することで、ヒトのiPS細胞からも移植治療に使える造血幹細胞を誘導できたことを示しているという。
ヒトiPS細胞から造血幹細胞が作製できたこと、またそれを利用した遺伝子矯正治療モデルに成功したことは、将来的にこの方法によりヒトの遺伝性を含む各種血液疾患の根治的治療に役立つ可能性を秘めていると、中内教授らは語る。
実際に遺伝子の突然変異によって正常な血液細胞が作れなくなり、免疫不全症、慢性肉芽腫症、血小板や赤血球の異常症などに苦しむ多くの患者がおり、例えばその患者の皮膚からiPS細胞を作り、変異してしまった遺伝子を正常なものに治療し、その正常化したiPS細胞から動物の体内で誘導した造血幹細胞を取り出し、患者自身に移植することで病気を根治的に治療することが可能になるというわけだ。
しかし、iPS細胞を完全に分化させないまま生体に移植すると腫瘍ができてしまうため、iPS細胞から作られた造血幹細胞が完全に分化した細胞であるという確認が必要になる。今回の成果から、骨髄に移動してきたiPS細胞由来の造血幹細胞をマウスに移植して腫瘍ができた例はないが、実際に人間に移植する場合は安全性の確保が重要な課題となるという。中内教授らは今後、さらに効率よくヒトの造血幹細胞を作製するため、どのような動物種が適しているのか、どのように安全性を確認するのかを検討していく予定とした。