名城大学は1月18日、名古屋大学(名大)、京都大学(京大)、米ジョンズ・ホプキンス大学の協力により、精神疾患が遺伝要因と環境要因の相互作用によって発症する仕組みの研究として、思春期のストレスは神経エピジェネティクス機構の障害を引き起こし、成体の行動パターン・神経系に影響を与えることを明らかにしたと発表した。
成果は、鍋島俊隆 名大名誉教授(現 名城大学 薬学部寄附講座 地域医療薬局学講座 特任教授)、丹羽美苗 名大大学院医学系研究科 特別研究員、名大大学院医学系研究科精神医学の尾崎紀夫 教授、同・博士課程2年生 松本友里恵氏、澤明 ジョンズホプキンス大学・統合失調症疾患センター・所長らによるもの。研究の詳細な内容は、1月18日付けで米科学雑誌「Science」電子版に掲載された。
成長・発達期である思春期での心理的ストレスなどの環境要因が遺伝子発現を変えることにより、脳の発達および成熟後の行動パターンに影響を与えてしまうことが、これまでの研究から知られている。この影響は成人になっても持続し、多様な精神疾患の発症に関わることから、予防法・治療法を開発するために、その神経メカニズムの解明が必要とされていた。そこで今回、研究グループは、マウスを用いた研究から、その解明に挑んだ。
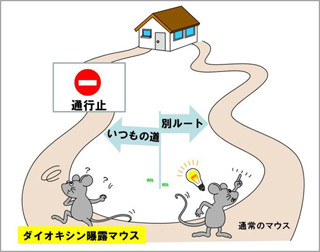
今回の研究では、精神疾患の発症に関わる可能性がある遺伝子「DISC1」を持ったマウスに対して、野生型マウスでは行動障害が観察されない程度の短期の隔離飼育をヒトの思春期にあたる時期(5~8週)に加えた時の、行動学的、神経化学的変化の観察が行われた(画像1)。
遺伝的要因のあるマウスを隔離飼育すると、成熟後に、刺激に対する反応性、情動性、注意力などに障害およびドーパミン作動性神経系の異常が見られた。特に、中脳皮質系ドーパミン作動性神経系と中脳辺縁系ドーパミン作動性神経系が異なる影響を受けていることが明らかとなった。
意志決定や注意に関係する中脳皮質系ドーパミン作動性神経系でのみ、ドーパミンを産生する「チロシンヒドロキシラーゼ遺伝子」のDNAメチル化が増加、すなわち、DNA塩基配列の変化を伴わないのに遺伝子の発現が変化(エピジェネティックな変化)し、この酵素の発現量が減少していることが判明した。この点に関して研究グループは、興味深いこととコメントしている。
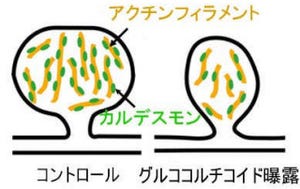
また、幻覚・妄想症状に関係する辺縁系だけ細胞外ドーパミン量が刺激時に増えることも確認された。隔離飼育後に、通常飼育を20週(マウスの成体期)まで行っても、この変化は持続したのである。この時、「血中コルチコステロン(ストレスホルモン)」量が増加していたが、これらの行動障害および神経化学的異常は、「グルココルチコイド受容体」を働かなくする拮抗薬「RU38486(ミフェプリストン)」によって正常化することが確認された(画像2)。
一方、遺伝的要因を持っているだけでは成熟後に行動障害が見られなかった。これらの結果から、精神疾患に関連する遺伝的要因があると、ストレスに脆弱となり、思春期のストレスはストレスホルモンを介して神経細胞の特異的な遺伝子に持続的な変化を引き起こし、それが成体期に持続的な行動異常をもたらすことがわかった。
成長・発達期のストレスと遺伝的要因との相互関係が、さまざまな精神疾患の発症に関わることはこれまでの研究から知られており、今回のマウス実験系はそれらの精神疾患の発症前および前駆期を含む発症メカニズムの研究や、新たな予防法・治療法開発に有用と考えられると研究グループでは説明している。例えば、ある遺伝的要因を持つヒトの場合、特定の環境要因を避けることによって、精神疾患を予防できる可能性があるとしている。
特に、グルココルチコイド受容体拮抗薬「RU38486」は幻覚・妄想症状を伴う難治性のうつ病性障害に対する治療薬としての試みがなされていることから、こうした疾患群に対する治療法開発に有用なツールとなる可能性もあるとしている。