慶應義塾大学(慶応大)は10月10日、順天堂大学の協力を得て、パーキンソン病患者からiPS細胞を作製し、病態メカニズムを再現することに成功したと発表した。
成果は、慶応大医学部 生理学教室の岡野栄之教授、同・今泉陽一研究員、順天堂大 医学部脳神経内科の服部信孝教授らの共同研究グループによるもの。研究の詳細な内容は、現地時間10月6日付けで英国医学雑誌「Molecular Brain」オンライン版に掲載された。
パーキンソン病は、主に50代後半から60歳代にかけて発症し、ゆっくりと進行する原因不明の神経変性疾患だ。日本におけるパーキンソン病の有病率は、1000人当たり約1名といわれ、日本全体では10万人以上の患者がいると推定されている。主に、手足の震えやこわばり、動作が緩慢になる、転びやすくなるといった運動症状を示す難治性疾患だ。
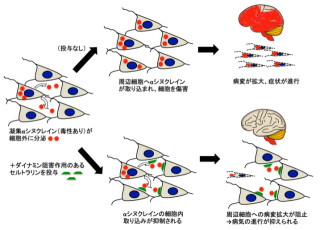
パーキンソン病の発症には、脳内の神経伝達物質であるドーパミンが減少することや、細胞内に異常タンパク質「αシヌクレイン」が蓄積することが関与していると考えられている。
近年では、新薬や「脳深部刺激療法」といった新しい治療法の開発により、パーキンソン病の経過は改善してきた。しかし、いずれも対症療法であり、副作用のため十分な薬が服用できない患者もおり、詳しい発症メカニズムは判っていないことから、根本治療がないのが現状だ。
これまでの研究から、パーキンソン病には特定遺伝子の変異が原因となり発症する「家族性」と、家族に発症者がいなくても発症する「孤発性」あることが判ってきた。
また、家族性パーキンソン病の一部では「Parkin(パーキン)」遺伝子が欠失していることが知られている。このParkin遺伝子が欠失した「パーキン変異」、もしくは「PARK2型家族性パーキンソン病」は、20歳代から発症することもある若年発症型だ。
また死後脳を用いた研究から、ドーパミンが減少していることが確認されていたものの、孤発性パーキンソン病で見られる異常タンパク質であるαシヌクレインの蓄積はほとんど報告されていなかった。
一方で、この遺伝子を欠失させた培養細胞やマウスによる実験から、上記現象が起こる以前に酸化ストレスが亢進し、ミトコンドリア機能異常が生じている可能性が示されている。しかし、実際の患者の発症以前・初期の脳内現象を正確にとらえることは技術的に不可能なため、病態の解明がなかなか進まないのが現状だ。
他方で、先般ノーベル医学・生理学賞を受賞された京都大学の山中伸弥教授らが開発したiPS細胞の技術は、患者の皮膚細胞から、これまでは入手困難だった神経細胞のような細胞も作製することを可能にした。そのため、パーキンソン病をはじめとする神経難病の研究に画期的な手法となることが期待され、世界的な研究競争が行われている。
しかし、患者iPS細胞由来の神経細胞で病態の一部を再現する報告はあったものの、細胞を提供した同じ患者の脳内で同じ現象が起きているかに関しては、まったく確認されていなかった。
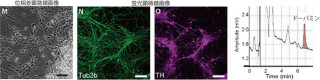
そこで研究グループは今回、2名のPARK2患者の皮膚の細胞から、山中教授らが開発した方法で皮膚線維芽細胞よりiPS細胞を作成し、神経細胞へ誘導。その結果、患者由来の神経細胞では、酸化ストレスが増強され、ミトコンドリアに機能異常が生じていることを確認することに成功したのである。
また、一方のPARK2患者の死後脳を観察したところ、家族性では蓄積しないと考えられていた異常タンパク質であるαシヌクレインが確認された。さらに、同じ患者から作製したiPS細胞由来の神経細胞を観察した結果、同様にαシヌクレインが蓄積していることが見出された次第だ。
これらの結果は、パーキンソン病患者iPS細胞由来の神経細胞を用いることで、同一の患者の脳内で起きている現象を忠実に再現することを世界で初めて証明したこととなる。
日本は超高齢社会に突入しており、今後ますますパーキンソン病患者数は増加するという予想だ。既存の治療薬では、根本的にパーキンソン病を治療することは難しい状況にある。その原因の1つには、実際の患者の脳内で起きている現象を正確に再現することができなかったからだ。
今回の成果は、患者由来のiPS細胞を用いることで疾患の病態解明を行えることを示したものであり、パーキンソン病を初めとするさまざまな疾患の病態解明や薬剤開発、早期診断法の開発につながるものと期待されると、研究グループは語っている。