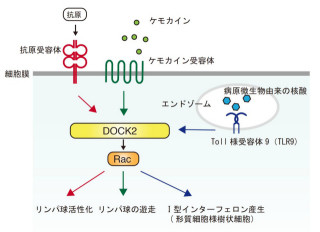
名古屋大学(名大)は5月30日、「Non-canonical Wntシグナル(非古典的Wntシグナル経路)」が制御する細胞移動の分子メカニズムを解明し、タンパク質「Daple」が足場タンパク「Dvl」と、タンパク質リン酸化酵素「aPKC」の結合を促し、低分子量Gタンパク質「Rac」を活性化すること、同シグナルによって細胞は移動方向へ向けて突起を伸ばし、移動できることがわかったと発表した。
さらに、このシグナルによる細胞集団の移動は皮膚の傷の回復に重要であることが、Daple遺伝子改変マウスの解析で明らかになったことも併せて発表。Dapleを失ったマウスは、通常のマウスに比べて傷の回復が遅く、Dapleは皮膚組織において、表皮細胞と真皮繊維芽細胞の損傷部位への移動を調節して、傷の回復に寄与している可能性が示唆された。
成果は、名大 大学院医学系研究科 病理病態学講座 腫瘍病理学分野の高岸麻紀研究員、同高橋雅英教授らの研究グループによるもの。研究の詳細な内容は、5月29日付けで英科学雑誌「Nature Communications」電子版に掲載された。
ヒトは、体の中で細胞の集団が移動することで、胎児期には各器官が正常に形成されたり、失った組織が回復(傷が治癒)したりする。一方で、がん細胞の移動が異常に亢進した場合は、がんの広がり(浸潤や転移)が起きてしまう。
Non-canonical Wntシグナルが低分子量Gタンパク質Racや「Rho」を活性化して細胞集団の移動を制御しているが、その詳細な分子機構は不明だった。特にRacを活性化する分子メカニズムは解明されていない。
また、皮膚の創傷治癒(傷の回復)過程において、Non-canonical Wntシグナルを刺激するWntタンパク質が発現誘導されることが知られていたが、そのシグナル作用は示されていなかったのである。
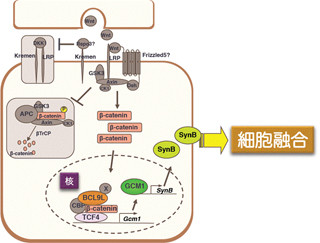
今回の実験において、遺伝子改変マウスを用いて細胞内にタンパク質Dapleを過剰に発現させると、足場タンパクDvlと、タンパク質リン酸化酵素aPKCの結合を促進。それによってaPKCが活性化され、さらに低分子量Gタンパク質Racを特異的に活性化することが確認された。
逆にDapleの発現を抑制させた場合、Wnt刺激で誘導されるDvlとaPKCの結合やRacの活性化が阻害されることもわかったのである。
これらの結果により、Wnt刺激後にDapleがDvlとaPKCの結合を促進し、それによってもたらされるaPKC活性によってRacを活性化していることが示唆された。
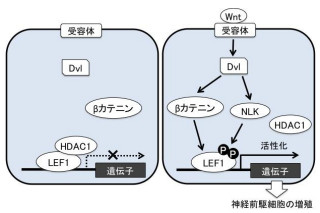
Non-canonical Wntシグナルで誘導される細胞集団の傷口への移動を評価(Wound healing assay)すると、Dapleによって傷口への移動を先導する「先導細胞」の先導端に突起「ラメリポディア」が形成された(画像1)。Dapleがないと、ラメリポディアの形成は失われることが確認されている。
これらの結果から、Non-canonical Wntシグナルがもたらす細胞集団の移動において、DapleがRacを活性化して先導端にラメリポディアを形成させているというモデルを提案した(画像2)。
最後に、皮膚の傷の回復過程で見られる皮膚組織の細胞集団の移動の解析が行われた。Daple遺伝子改変マウスは、通常マウスに比べて皮膚の傷の治癒が遅いことが判明(画像3)。
Dapleは皮膚組織の中でも表皮細胞と真皮の繊維芽細胞に発現しており、Daple遺伝子改変マウスからこれらの細胞を分離して培養すると、Racの活性化や細胞集団の移動能が低下していた。Dapleを欠いたこれらの細胞では、Wnt刺激で誘導される細胞の移動が抑制されていたのである。
これらのことから、皮膚の傷の治癒において、Non-canonical Wntシグナルが表皮細胞と繊維芽細胞の移動を制御していることが示された。また、DapleがNon-canonical WntシグナルのRacの活性化をもたらすことで、傷の治癒を促している可能性も示唆された形だ。
細胞移動をもたらすNon-canonical Wntシグナルは、Wntの過剰な発現によって胃がんの転移や前立腺がんの進行に関与していることが知られている。DapleはこのNon-canonical Wntシグナルによる細胞移動を制御しているので、がんの進行を調節している可能性があるという。
そのため、今回の研究は傷の治癒だけでなく、がんの浸潤や転移を抑える新しい治療法の開発につながることが期待されると、研究グループはコメントしている。