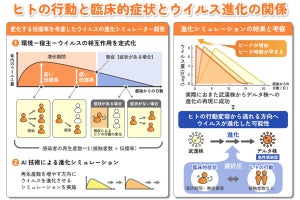
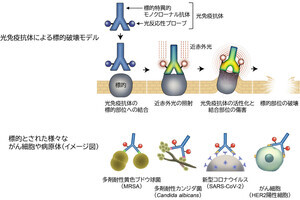
富山大学、京都大学(京大)、北海道大学(北大)の3者は1月16日、変異の激しい新型コロナウイルスに対抗し、非常に素早く行える分子シミュレーションを活用した、抗体医薬品のユニバーサル化デザイン技術を考案し、実証実験によりその有効性を証明したことを共同で発表した。
-

分子シミュレーション解析を用いて、UT28Kの2アミノ酸の変位(T28RとN57D)を導入した改変型抗体UT28K-RDが実際に作製され、解析が行われた。すると、BA.1株由来の変位であるQ493Rに対し結合活性が回復したこと、BA.1株に対し中和活性が回復したこと、UT28K-RDとRBDとの間に新たな相互作用が追加されたこと、の3点が実験的に観察された(出所:共同プレスリリースPDF)
同成果は、富山大 先端抗体医薬開発センター・学術研究部医学系の小澤龍彦准教授、京大 高等研究院 物質-細胞統合システム拠点の池田幸樹 特定拠点助教、京大 医生物学研究所の橋口隆生教授、北大大学院 薬学研究院の前仲勝実教授、北大大学院 医学研究院の福原崇介教授、京都府立医科大学 医学系研究科の星野温講師、富山県衛生研究所の谷英樹部長らの共同研究チームによるもの。詳細は、構造生物学とその関連分野に関する全般を扱う学術誌「Structure」に掲載された。
富山大の研究チームが2021年に開発した「スーパー中和抗体」(開発番号:UT28K)は、野生(武漢)株に加え、アルファ株からイプシロン株まで6種類の変異株に対しても中和活性を示す。しかし、オミクロンBA.1株(以下、BA.1株)に対しては、同株由来の変異により、中和活性が大幅に落ちることがわかっていた。
新型コロナウイルスがヒト細胞に侵入する際、ヒト細胞表面の「ACE2受容体」に結合する部位が、ウイルスのスパイクタンパク質上の「RBD」だ。同部位に対し、UT28Kが結合する際に必要なエピトープ(標的部位)の1つが「Q493」だが、BA.1株はそのQ493Rに変異があった。つまり、BA.1株がUT28Kに対する耐性を獲得したと考えられるとする。そこで研究チームは今回、分子シミュレーション解析を用いて、BA.1株に対応するための変異をUT28Kに導入したという。
-

UT28Kの改変。1つ目として、Q493との結合に必要だったN57に変異が入れられた(N57D)。2つ目として、UT28KとRBDの間にあった隙間が埋められた(T28R)(出所:共同プレスリリースPDF)
Q493変異に対する変異(N57D)と、UT28KとRBDの間に存在した隙間を埋めて結合を強化するための変異(T28R)が導入され、改良版「UT28K-RD」と命名された。
BA.1株をハムスターに感染させ、その後にUT28K-RDを投与する中和活性測定実験を行った結果、UT28K-RDの投与で肺のウイルスが減少することが確認されたとする。
-

動物モデルを用いたUT28K-RDの中和活性評価。ハムスターにBA.1株を鼻腔感染させ、6時間後に抗体が腹腔内投与された。その後、肺におけるウイルスゲノムの定量と肺における病理評価が行われた(出所:共同プレスリリースPDF)
次に、UT28K-RDがQ493R変異に結合できるようになったのか、またUT28K-RDに改変したことでRBDに対する結合に影響が出るのかが調べられた。作製されたRBDの変異ライブラリーと、UT28K-RDとの結合を網羅的に解析したところ、UT28K-RDはQ493Rに結合することが実験的に認められた。またUT28K-RDには、結合に負の影響がないことも判明した。
-

UT28K-RD改変による結合への影響。UT2KはQ493R変異には結合できないが、UT28K-RDはQ493Rに結合できる。赤は結合できなくなる変異、青は結合できる変異。斜線は武漢株のアミノ酸、黒いドットの大きさは、GISAIDデータベースによるウイルスゲノム配列中の頻度を反映する(出所:共同プレスリリースPDF)
加えて分子シミュレーション解析の精度向上のため、実際にUT28K-RDとBA.1株のRBDとの構造が観察された。まず、UT28K-RDのT28R変異により「I31」がRBDの「Y489」と結合することが予測され、実験的にもそれが確かめられた。他にもT28R変異で起こる影響が予測されたが、実験的に観察された構造と概ね同じであることがわかったという。
-

UT28K-RDとBA.1株RBDの立体構造解析。T28R変異により、UT28K-RDのI31とBA.1株のY489が相互作用することが観察された。またN57D変異により、UT28K-RDのS55とBA.1株のQ493Rが相互作用し、N57DはS55とQ493Rの結合をサポートすることが観察された(出所:共同プレスリリースPDF)
続いてUT28K-RDのN57D変異については、当初N57DがRBDのQ493Rと結合すると予測されていたが、実際は「S55」がQ493Rと結合していたことが観察された。N57D変異自体は、S55がQ493Rと結合するためのサポートをしていることが明らかにされた。
研究チームは最後に、UT28KとUT28K-RDの比較を実施。UT28KはRBDの「F486」および「N487」を主要なエピトープとしており、UT28K-RDも同じであることがわかった。F486およびN487に変異が入ると結合しなくなるということであり、現在主流のオミクロンXBB1.5株やEG.5株などはF486に変異が入っているため、UT28K-RDの中和活性が損なわれることを示唆しているとする。
今回の研究で、ウイルスの変異により中和活性が無効となってしまった抗体を、分子シミュレーション解析を用いて改変することで中和活性を回復させられることが示された。しかし、同解析を用いた改変は万能ではないといい、今回の研究のように、同解析での抗体改良予測と実験的に観察される構造の両方のデータから、信頼できるか否かについての評価をフィードバックする必要があるとする。
また今回の手法は、抗体医薬品の改良設計を1か月程度で実施可能であることから、ウイルスの変異速度と並びうる迅速なデザインができること、そしてスーパーコンピュータによる高価かつ高コストな計算を使わず設計に成功した点も優れた点とのこと。今後、同様の事例を積み重ねることで、分子シミュレーション解析での予測精度の向上が見込まれ、ウイルスの変異に対抗できる中和抗体開発が進むことが期待されるとしている。