大阪大学(阪大)は3月29日、パーキンソン病の原因と知られていながら、患者の約9割においてメカニズムが不明だった、タンパク質「αシヌクレイン」(αSyn)の異常な凝集体(レビー小体)形成について、リン脂質「ホスファチジルイノシトール3リン酸」(PIP3)が蓄積することがきっかけであることを明らかにしたと発表した。
同成果は、阪大大学院 医学系研究科 神経内科学の鐘其静特任研究員、同・池中建介助教、同・望月秀樹教授らの研究チームによるもの。詳細は、ヒト細胞のメカニズムや神経疾患の病理学に関する全般を扱う学術誌「Acta Neuropathologica」に掲載された。
パーキンソン病の原因として中心的な役割を果たしているのが、αSynの凝集であるレビー小体だ。αSynは中枢神経に豊富に発現しているタンパク質で、それが異常な凝集体を形成することでパーキンソン病の原因になることが知られている。
しかし、なぜαSynが凝集蓄積するのかは、まだ十分にわかっていなかった。パーキンソン病患者のうちのおよそ1割程度では、遺伝的に糖脂質「グルコシルセラミド」が蓄積しやすい体質を持ち、過剰なグルコシルセラミドがαSynと結合することで凝集を起こすことは知られていた。しかし、それ以外のおよそ9割の患者の原因は不明だったとする。
そうした中で研究チームは以前に、残り9割の患者のレビー小体にも、αSynの凝集と一緒に何らかの脂質が蓄積していることを見出した。そこで今回、脂質がαSynの性質を変えて凝集させるという仮説を立てて、詳細な分析を行ったという。
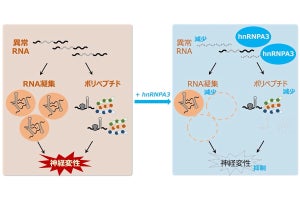
まず、メンブレンストリップ法を用いて、αSynと結合する脂質の探索が行われた。すると、PIP3が強く結合することが見出されたとする。そこでPIP3とαSynの混合を行ったところ、αSynが異常な構造を持つ凝集体を作ることが判明した。さらに、この凝集体の形や性質を調べた結果、いくつかあるαSynが蓄積する病気の中で、特にパーキンソン病患者の脳内で蓄積するαSyn凝集体と形や性質が類似していることが確かめられたという。
続いて、培養細胞や神経細胞においてPIP3が蓄積する処置を行ったところ、リソソームやシナプス終末といった、実際の患者でαSynが凝集を開始する場所において、PIP3と一緒に凝集蓄積するαSynが観察されたという。そこで、質量分析や免疫染色を用いて、患者の脳組織のPIP3の量が測定された。すると、パーキンソン病患者において過剰に蓄積していることが明らかになったという。さらに、免疫染色でαSyn凝集体とPIP3が一緒に凝集していることも示されたとする。
研究チームは今回の研究成果により、不明だった9割のパーキンソン病患者におけるαSynのレビー小体形成のメカニズムとして、PIP3の過剰な蓄積がきっかけになっていることが示唆されたとする。このことから、PIP3がパーキンソン病のバイオマーカーになり得る可能性や、PIP3の過剰な蓄積を抑える治療、αSynとの結合を阻害する治療といった、これまでとはまったく異なる新しい治療戦略が今後展開される可能性が考えられるとしている。