広島大学と大阪大学(阪大)は11月4日、統合失調症の新薬につながる可能性がある神経ペプチド受容体「VIPR2」の選択的な阻害ペプチドを創製したと発表した。
同成果は、広島大大学院 医系科学研究科 細胞分子薬理学の吾郷由希夫教授、阪大大学院 薬学研究科 薬剤学分野の中川晋作教授、一丸ファルコスの坂元孝太郎主席研究員らの産学共同研究チームによるもの。詳細は、神経薬理学を扱う学術誌「Frontiers in Pharmacology」に掲載された。
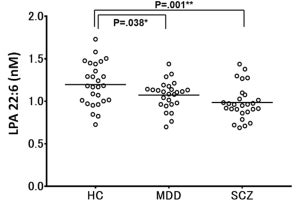
統合失調症は、幻覚や妄想などの陽性症状、意欲の低下などの陰性症状、そして注意・集中力の低下や記憶力・判断力の低下といった認知機能障害などを特徴とする精神疾患で、その罹患者は日本で約80万人、全世界で2000万人以上いるといわれている。
既存の治療薬は、いずれも神経伝達物質のドーパミンやセロトニンなどの働きを調節する作用機序を有しているが、限定的な治療効果が課題だという。
共同研究チームを含む複数の研究成果により、これまでに、神経ペプチドの受容体の1つであるVIPR2の発現量の増加や過剰な働きが、統合失調症と強い関連があることが明らかになってきた。このことから、VIPR2の機能を抑える(阻害する)化合物が、新しい統合失調症の治療薬になる可能性が示唆されている。しかし、この受容体の持つ構造上の特徴や、神経ペプチドが複数の異なる受容体に結合することなどの理由から、VIPR2選択的な阻害薬の開発は難航していたという。
そこで研究チームが今回着目したのが、分子量が1500程度の中分子のペプチド化合物だという。これまでの統合失調症治療薬では、分子量400程度の低分子化合物が用いられてきたとのことで、大きく方針を変えることにしたという。その結果、VIPR2受容体に対する高い選択性と強力な阻害作用の両方を実現することに成功したという。
また同ペプチド化合物は、配列内に2か所の架橋構造(環状化)を有するユニークな構造を有していることが特徴であり、この構造が血液中で分解されにくく、高い安定性を示すことも明らかにされた。
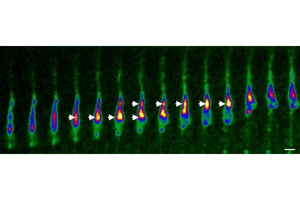
さらに、統合失調症のモデルマウスを作製し、同ペプチド化合物の効果を検証したところ、マウスの発育早期におけるVIPR2の過剰な活性化による神経細胞の未成熟状態が改善され、認知機能障害の発症も抑制されることが確認されたという。ただし、同ペプチド化合物の安全性や体内での薬物動態はまだ不明であることから、今後、細胞や動物モデルなどを用いたさらなる検討、そしてヒトでの臨床試験によって、VIPR2阻害ペプチドの有効性と安全性を確認していくことで、統合失調症の新しい治療薬として登場することが期待されるとしている。