東京工業大学(東工大)は、出芽酵母のプリオンタンパク質が、どのように多量体やアミロイド繊維を形成するかを直接観察することに成功。この結果、これまで明らかになっていなかったアミロイド線維形成のメカニズムの一端を解明した。
なお、プリオンとはタンパク質性の感染因子のことである。また、アミロイド繊維とは分子間でβシート(タンパク質の二次構造の1つ)が規則正しく重合したタンパク質の繊維構造のことであり、通常のタンパク質の立体構造とはまったく異なる構造状態である。
同成果は、東京工業大学 生命理工学院 生命理工学系の奥田桃子氏(研究当時 博士後期課程3年)、田口英樹 教授および金沢大学ナノ生命科学研究所の紺野宏記 准教授、中山隆宏 准教授、安藤敏夫 特任教授らの研究グループによるもの。詳細は、米国科学アカデミー紀要電子版に掲載された。
生命現象を担うタンパク質はアミノ酸が数珠状につながった鎖であり、鎖が特定の立体構造を形成して機能を発揮するのが基本だが、老化などの原因により異常な立体構造になることがある。異常構造のひとつは「アミロイド」という繊維状のタンパク質で、アルツハイマー病など多くの病気に関係することが知られている。
一方、病気に関係しないアミロイド繊維も知られており、酵母プリオンタンパク質が形成するアミロイド繊維はその一例である。哺乳類より単純な単細胞生物である酵母でのプリオン研究は、アミロイドやプリオンのよいモデルとして多くの研究が進められてきた。しかし、アミロイド繊維が伸びていく詳細な仕組みについては、これまでよく分かっていなかった。
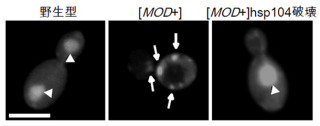
今回、研究グループは、代表的な酵母プリオンタンパク質「Sup35」を用い、高速原子間力顕微鏡(高速AFM)という装置で、アミロイド繊維形成の観察を行った。高速AFMは、タンパク質の一個一個の動きを直接捉えることができる装置。その結果、酵母プリオンタンパク質が形成する多量体の動きやアミロイド線維が伸長する様子を、0.05秒程度の時間分解能かつ0.1nm(ナノメートル)程度の空間分解能で観察することに成功した。
さらに、特定の立体構造を取ることができずに変性している状態のタンパク質が繊維末端に融合してアミロイドとなり、繊維が伸長することを示唆する結果を得たことから、酵母プリオンタンパク質が多量体やアミロイド繊維を形成するメカニズムについて、新たなモデルを提案した。
研究グループは、今回の研究は、アミロイド繊維になる前のタンパク質の状態に関する新たな知見を含んでおり、タンパク質の異常状態であるアミロイド繊維が形成されるメカニズムの解明に貢献するとともに、クロイツフェルト・ヤコブ病などのプリオン病やアルツハイマー病などのアミロイドが関わる病気の病態の解明、創薬などへの波及効果も期待できるとしている。