東京工科大学は4月27日、プログラムされた細胞死「アポトーシス」をがん細胞に誘導する新しい核酸の創製に成功したと発表した。
同成果は、東京工科大学大学院バイオニクス専攻 杉山友康教授らの研究グループによるもので、4月22日付の国際科学誌「Biochemical and Biophysical Research Communications」に掲載された。
細胞は、個体が恒常性を保つための重要な仕組みとして、アポトーシスという細胞死するための内在的な機構を持っている。たとえば、DNA傷害のような過剰なストレスを受けた場合、自らを消化して存在を抹消するが、これには細胞内のミトコンドリアが関わっており、その膜電位の消失がアポトーシスを誘導するものと考えられている。
一方、RNA干渉法という遺伝子の発現を特異的に抑制する方法が、遺伝子の機能を調べる方法として広く利用されている。近年ではその高い有効性と特異性を活かして医薬品への利用が検討されている。
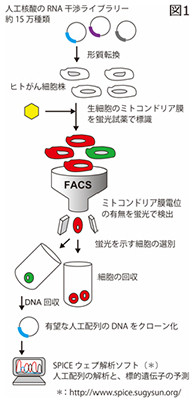
今回、同研究グループは、独自開発した遺伝子情報解析支援システムと人工配列の核酸ライブラリを利用することで、がん細胞のアポトーシスを誘導する核酸の特定を目的としたスクリーニングを実施した。
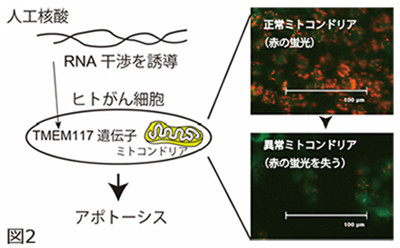
具体的には、さまざまなDNA配列の人工核酸を、ヒト結腸がんの細胞株HCT116に作用させ、ミトコンドリア膜電位の消失を誘導する人工核酸を探索。この結果、効果を示す核酸が約15万種類のなかからひとつ発見された。
この核酸はヒトゲノム配列と比較して完全一致しない塩基配列であったが、同研究グループはその標的遺伝子を特定。未解明の膜タンパク質「TMEM117」であることを突き止めた。
TMEM117の遺伝子発現抑制は、細胞内の活性酸素種レベルを上げ、ミトコンドリア経路のアポトーシスを誘導し、がん細胞株の増殖性を著しく抑制した。同様の効果は、ヒト子宮頸がんの細胞株HeLaでも確認されている。またTMEM117の機能として、がん細胞がアポトーシスする反応経路に関わることが示された。
|
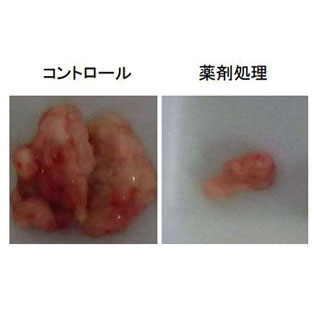
TMEM117を標的とする人工核酸のがん細胞に対する効果。人工核酸はがん細胞内に導入されると、TMEM117の発現を抑制し、がん細胞のミトコンドリア膜電位は消失(図の赤色蛍光が消える)、アポトーシスが誘導される。これにより、がん細胞の細胞増殖性が著しく抑制される (出所:東京工科大Webサイト) |
同研究グループは、今後TMEM117の機能解明が進むことで、がん細胞死を誘導する核酸医薬品の開発が期待されると説明している。