久留米大学は2月7日、血液の分解プロセスの最終段階であり、新生児黄疸の原因にもなる生体内反応の仕組みを明らかにしたと発表した。
同成果は、宮崎大学テニュアトラック推進機構の和田 啓 准教授、久留米大学医学部医化学講座の杉島正一 准教授、埼玉大学大学院理工学研究科の高橋康弘 教授、大阪大学、農研機構、久留米高専などで構成させる研究グループによるもの。詳細は英国科学誌「Nature Communications」で公開された。
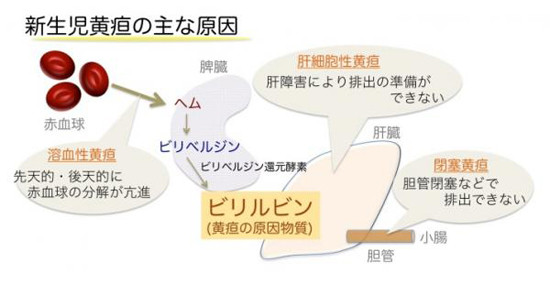
血液中の酸素運搬成分であるヘムを分解するビリベルジン還元酵素は、黄色を呈する色素であるビリルビンを産生することが知られている。ビリルビンは抗酸化作用を有しているが、血液分解の盛んな新生児の体内で過剰に存在すると重度の黄疸を引き起こし、脳内に沈着して神経毒性をもたらすことが知られているものの(ビリルビン脳症)、ビリルビンの産生反応がどのような機構で進むのかは良く分かっていなかった。
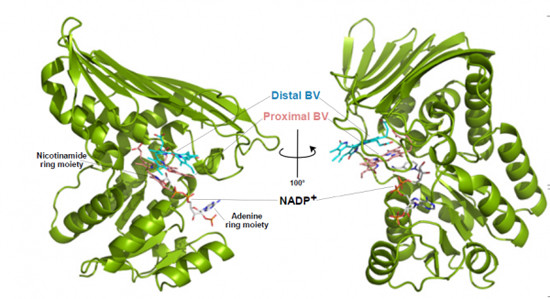
研究グループは今回、分子レベルでその謎の解明に挑んだという。具体的にはタンパク質の立体構造を分子・原子レベルで可視化できるX線結晶構造解析法を用いてビリベルジン還元酵素、ビリベルジン、補酵素の3成分を調査。これまで不明であったたビリベルジン還元酵素がビリベルジンを結合した状態の立体構造決定に成功したという。
さらに詳細に調査を行ったところ、ビリベルジン還元酵素は、基質(ビリベルジン)2分子を1つの場所で、同時に結合していること、片方がもう片方をビリルビンに変換する触媒として機能していることを突き止めたとする。実際にビリベルジン還元酵素の結晶を用いた反応を進めたところ、青色結晶(2分子のビリベルジン結合の呈色)が黄緑色結晶(1分子のビリベルジン+1分子のビリルビンの呈色)に変化することが確認されたという。
なお、今回の成果について研究グループでは、新生児の軽度の黄疸には、光によって変化したビリルビンが体から排出されやすい、という特性を利用した光照射治療が行われているが、重度の場合、有効な治療薬がないことから、血液の全交換が必要とされているが、今回の知見を活用することで、黄疸治療薬の開発につながる可能性が出てきたと説明している。