京都大学と科学技術振興機構(JST)は3月7日、大阪大学、カン研究所との共同研究により、臨床応用に向けたヒトiPS細胞由来「ドーパミン神経前駆細胞」の製造方法を開発したと共同で発表した。
成果は、京大 iPS細胞研究所(CiRA) 臨床応用研究部門の土井大輔研究員、髙橋淳 教授、カン研究所の尾野雄一主幹研究員らの研究チームによるもの。研究の詳細な内容は、米国東部時間3月6日付けで米科学誌「Stem Cell Reports」に掲載された。
パーキンソン病は、「中脳黒質」から線条体に投射するドーパミン神経細胞が減ることで、脳内に放出される神経伝達物質のドーパミン量が減り、手足の震えや体のこわばり、運動減少などの症状が出る進行性の神経難病だ。
現在では薬物や電極を用いた治療法によって症状の改善をすることは可能になったが、ドーパミン神経細胞の減少そのものを食い止めることはできていないため、病状の悪化に伴い症状の改善が困難になってしまうという大きな課題があった。そこで、細胞移植によってドーパミン神経細胞を補い、新たな神経回路の形成を促して脳の機能を再生させるという、より積極的な治療法に期待が寄せられている。その移植細胞の供給源の1つとして、ヒトiPS細胞が考えられているというわけだ。
そのiPS細胞も、現状では大きな課題があるのはよく知られた事実だ。iPS細胞は高い増殖性を持つことが特徴の1つだが、その反面、移植片として患者に投与する際には、増殖能力を持った細胞が残ってしまった場合には腫瘍化するリスクを常に考慮しなければならない。
一方、iPS細胞のような多能性の細胞で実際にドーパミン神経細胞の再生医療が可能になるかどうかは、以前の高橋教授らの実験が証明している。髙橋教授らは、ヒトES細胞由来の神経細胞を霊長類に移植した実験を行っており、ES細胞由来のドーパミン神経細胞が多数脳内に生着し神経症状を改善させることを明らかにしたのだ。ただし、同実験においてはヒトES細胞の残存は見られなかったものの、未熟な神経細胞がわずかに増殖していることは観察されている。
また、以前の方法では移植片の中にさまざまな細胞が混在しており、パーキンソン病治療に必要とされるドーパミン神経細胞が含まれる割合は比較的低いという課題もあった。従って臨床応用に際しては、増殖の可能性のある細胞を排除し、ドーパミン神経細胞の割合を高めることが必要だったのである。
さらに、臨床応用を行うには1000万~1億個台という大量の細胞が必要で、その上、動物由来成分を含まない条件で培養する必要もあり、新たな培養法の開発が必要だった。そこで高橋教授らは今回、これらの課題を解決するために、分化誘導方法を改良すると同時に、「セルソーティング(FACS:Flurorescence-activated cell sorting)」によるドーパミン神経前駆細胞の選別を試みたのである。
なおFACSとは、目的の細胞だけを分取する技術のことである。FACSは、蛍光抗体で染色した細胞を液流に乗せて流し、レーザー光の焦点を通過させ、個々の細胞が発する蛍光を測定することによって細胞表面にある抗原量を定量的に測定し、その情報を基に特定の細胞だけを生きたまま無菌的に分取できるというものだ。
これまで神経誘導のための接着培養ではマウス細胞由来の基質である「マトリゲル」が用いられていたが、動物由来であるため臨床に用いることは不可能である。そこで研究チームは、阪大 タンパク質研究所と共同研究を行い、ヒトiPS細胞をマトリゲルの代わりに組み換え「ラミニン511E8フラグメント」上で培養し、ドーパミン神経前駆細胞を誘導することにした。ラミニンとは、細胞を接着させるために重要なタンパク質のことだ。上皮細胞や筋細胞、血管内皮細胞などさまざまな細胞で分泌合成されており、またさまざまなタイプがあり、細胞の種類によって作られているラミニンも異なる。そして今回は、高密度培養を実施。細胞をバラバラに分散させて、数1000個程度の固まりにした状態で培養する「浮遊培養法(Serum-Free Embryonic Body quick:SFEBq法)」と比較して、20倍以上の神経前駆細胞を得ることに成功したという。
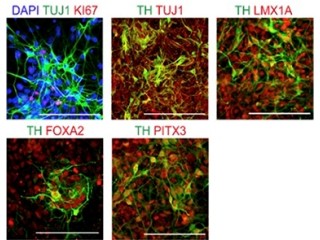
さらにカン研究所との共同研究により、胎生期の神経管の腹側で発現している表面抗原「コリン」を用いたソーティングが行われ、ドーパミン神経前駆細胞のマーカーである「FOXA2」と「LMX1A」を発現する細胞が約80%まで濃縮された(画像1・2)。
そして、選別された細胞は高効率にドーパミン神経細胞へと分化し、「脱分極」してドーパミン分泌を行っていることも確認されたのである。脱分極とは神経細胞の活動の1つで、細胞膜内にはマイナスの静止膜電位が存在しているが、刺激を受けるとマイナスの電位が減少し、そのことをいう。脱分極により膜電位がある程度まで減少すると、能動的な活動電位が生じる仕組みだ。

|

|
|
ヒトiPS細胞から作製したドーパミン神経前駆細胞の免疫染色。抗コリン抗体を用いて選別することで、ドーパミン神経前駆細胞に特徴的なマーカー(緑:FOXA2、赤:LMX1A)で染色される細胞(黄色)が濃縮できた。画像1(左)はソーティングなし、画像2(右)はソーティングあり |
|
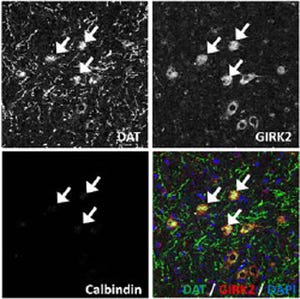
次にパーキンソン病モデルラットの脳内へ移植することにより、作製したドーパミン神経前駆細胞の安全性と有効性について検討が行われた(画像3)。移植後4ヵ月の時点では、ソーティングした細胞由来の移植片はソーティングしないものよりも移植片が均一で有意に小さく、移植片内の増殖細胞はごくわずか(0.1%未満)であることが判明したのである(画像4)。
さらにラットの運動機能は改善し、脳切片の免疫染色では、ソーティングした細胞の移植片で有意に多くのドーパミン神経細胞が生着していることが確認された。また、ソーティングのタイミングや移植のタイミングについて検討がなされたところ、分化誘導開始後12日目にソーティングを行い28日目に移植が行われた場合に最良の結果が得られることが明らかになったのである。
iPS細胞を用いた細胞移植治療では、増殖性細胞の残存による移植片の腫瘍化が問題とされている。今回の研究では、「抗コリン抗体」を用いたFACSを行うことで腫瘍化の危険性がある細胞を除去し、さらに移植片内の中脳ドーパミン神経細胞の割合を高めることで、より安全かつ効率的な移植が可能となった。
なおコリン抗体とは、前述した表面抗原のコリンだけを特異的に認識する抗体である。この抗体に蛍光物質を結合させておくことで、表面にコリンを持っている細胞だけに蛍光標識することができ、FACSが可能となる。
また、これまでのiPS細胞の培養や神経誘導にはマウス由来のフィーダー細胞が必要だったがそのままでは臨床応用はできず、また神経誘導の際には浮遊培養が可能だったが大量培養には不向きだった。しかし今回、組換えラミニン511E8フラグメントを使用することで、臨床に使用できる細胞を大量に培養することが可能になった形だ。こうした改良を加えることで、臨床応用に向けたプロトコルを確立できたことに意義があるとしている(画像5)。
今後は、臨床応用を開始する前に、このプロトコルで作製された細胞を霊長類モデルにも移植し、より長期の経過観察を行うことによって、安全性や有効性をより詳細に確認する予定としている。また、iPS細胞は自家移植が可能だが、パーキンソン病患者由来のiPS細胞から作製したドーパミン神経が脳内で機能するかについても検討が必要だという。これらの課題をクリアした上で、臨床応用に進む考えであるとしている。