京都大学は10月4日、強力に体内時計を刻む脳の視交叉上核の巨大な「アルギニンバゾプレッシン(AVP)」神経細胞群が発現する「V1a」および「V1b」受容体を働かなくすると時差ボケへの順応が早くなるという、時差ボケが起こるまったく新しい仕組みを解明したと発表した。
成果は、京大 薬学研究科の岡村均教授、同・山口賀章助教らの研究チームによるもの。研究の詳細な内容は、日本時間10月4日付けで米科学誌「Science」に掲載された。
海外への移動で大変なことの1つが時差ボケである。夜間に眠れず、昼間に眠くなってしまう理由は、ヒトの体の中に、時間を正確に刻み続ける時計、いわゆる体内時計(概日時計、サーカディアンリズム)が存在しているためだ。地球上の生命体は何億年もかけて、約24時間のリズムを刻む概日時計システムを確立してきた。特に夜行性のほ乳類になると、この概日時計システムが高度に発達する。夜でも刻み続ける体の中の時計により時間を予測し、朝を予測し、心置きなく夜に活動していたのだ。
現在は昼行性であるヒトも、祖先をたどれば結局は夜行性のほ乳類に行き着くので、この強力な時計を現在も持っている。この強く安定した体内時計がかえって仇となり、海外旅行中にはすぐには現地時間に馴染めず、時差ボケになってしまうというわけだ。
このように時差ボケはその仕組みがよくわかっているように思われがちだが、実はそのメカニズムはこれまでのところ不明である。今回の研究において研究チームは、強力な時間を作り出す脳の「視交叉上核」の時間生物学研究から、時差症状を示さないマウスの開発に成功した。
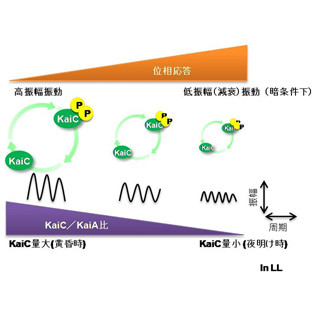
視交叉上核の約半数の神経細胞は、AVPを発現している。また、この数100にもおよぶ巨大なAVP神経細胞群は、AVP受容体であるV1aおよびV1b受容体も発現。お互いの細胞間で視交叉上核内の局所神経ネットワークを形成している。しかし、この神経回路の機能が長らく不明だった。
そこで研究チームは今回、V1aとV1b受容体を共に欠損したダブルノックアウトした「時差消失マウス」を作り出して実験に臨んだ。その結果、明暗環境を変化させた時に生じる行動リズムの時差が完全に消失することが発見されたのである。マウスを飼育する明暗環境を8時間早めて時差を起こすと、正常マウスでは新しい明暗環境に順応するのに10日間程度を要するが、時差消失マウスでは、瞬時に順応することが確かめられたのだ(画像1・2)。
また、視交叉上核では概日リズムが時計遺伝子「Per1」のリズミックな遺伝子発現で作られるが、この時計遺伝子の発現リズムも、時差を起こした後に正常マウスでは8日後に回復したが、時差消失マウスでは3日後と非常に素早く回復することが確認された(画像3)。末梢臓器である肝臓や腎臓の時計遺伝子の発現リズムや体温のリズムも、時差消失マウスは正常マウスよりも早く回復することが判明している。
続いて、時差を起こした後に、時差消失マウスが素早く順応できる理由の検討が行われた。視交叉上核の切片培養を用いた研究から、研究チームは、AVPのV1aおよびV1b受容体を介する視交叉上核のAVP細胞間の局所神経回路が、安定した概日時計システムの維持に寄与しているものと考えているという。すなわち、この神経回路のおかげで、正常マウスは外界の明暗環境の変化に左右されず、自身の体内時計を正確に刻み続けることができるというものだ。
体内時計を動かすことのできる最大の力は眼から入る光である。夜でも、満月や山火事や雷鳴など不意の明るさでもって、夜が明けて昼になったと誤認して、すぐ狂ってしまうような脆弱な体内時計では、生存競争を勝ち抜けなかったのだろうと、研究チームは推測する。強力な体内時計は、夜行性となることで生き延びてきたほ乳類にとっては、重要なカギだったというわけだ。
このように、生物は何億年もかけて自律した体内時計システムを確立し、それが強力で安定したリズムを刻む視交叉上核を持つほ乳類で頂点に達したのだが、ジェット機での海外への移動が一般化した現代では、その安定性が逆に仇となって、時差の原因となっているという。すなわち、頑固な体内時計は容易に現地時間には馴染めないのである。
とはいえ、今後もますます海外への移動は増えることが予想される。また、海外旅行をしなくとも、グローバル経済は交替制勤務や長時間労働が当たり前となり、24時間活動が行われるようになってきた。時差勤務を避けることができないシフトワーカーも増加の一途をたどっている状況だ。また夜のテレビやゲームなど娯楽で睡眠時間がイレギュラーな人も多い。
このように、時差は本当に身近で日常的になっているのだが、こういう生活が長く続くと、健康障害になる可能性が上がる。事実、シフトワーカーの生活習慣病(高血圧、メタボリック症候群、がんなど)の増加がいわれている。
そして研究チームは、V1aとV1b受容体を障害させたマウスの結果から、この受容体機能を一時的に薬でブロックすることで、時差を改善できるものと推測。そこでV1aとV1b受容体の拮抗薬を、正常マウスの視交叉上核に直接投与したところ、時差を著明に軽減させることに成功したのである(画像4・5)。
今回、リズムセンターである視交叉上核がなぜ強力なリズムを形成するのか、その秘密の1つに視交叉上核の主要細胞であるAVPニューロン相互の神経間伝達があることが明らかにされた。この細胞間連絡を阻害すると、環境の明暗周期の変動にきわめて脆弱となり、体内時計が容易に環境の明暗周期に同調することが判明した形だ。
環境の明暗周期に容易に同調するとは、時差ボケしないということだ。逆説的だが、V1aとV1bを消失した方が、時差が軽くなるというわけである。今回の実験ではマウスが用いられたわけだが、ヒトにも視交叉上核はあり、またその中のAVPニューロン系は主要ニューロン系として存在するので、同様の機構がヒトにもあることが想定されるという。
V1aV1bアンタゴニストの適用による時差の軽減は、この視交叉上核のニューロン相互の神経伝達をターゲットにしたまったく新しい創薬だ。視交叉上核をターゲットにしたこの結果は、海外渡航に伴う時差ボケだけでなく、睡眠障害や生活習慣病といったシフトワーカーの病態の新たな治療薬の開発につながるものとして期待されるとする。今後、引き続き、詳細な時差の分子・細胞メカニズムをシステムレベルで解明していき、より時差ボケを軽減できる効果のある化合物を開発したいとした。