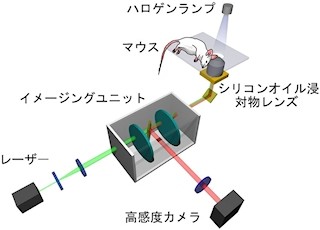
九州大学(九大)は7月24日、白血球の1種の「好中球」が病原菌に向かって真直ぐに移動(遊走)するためには、細胞内にあるタンパク質「mInsc(エムインスク)」が必要であることを見出し、さらにmInscが働く分子メカニズムを明らかにしたと発表した。
成果は、九大大学院 医学研究院の住本英樹 教授、鎌倉幸子助教らの研究チームによるもの。研究の詳細な内容は、米国東部時間7月25日付けで「Developmental Cell」オンライン速報版に掲載され、印刷版には8月12日に掲載される予定だ。
血液中の白血球は、病原性の微生物が侵入すると、血管から出て組織内を移動し侵入部位に至り、病原菌を排除しようとする。好中球は白血球の中で最も多い細胞で(血液中の白血球の内半分から3分の2は好中球)、細菌や真菌(カビの仲間)を殺菌する上で主役となる細胞だ(一方、ウイルス感染に対してはリンパ球が必須の役割を果たす)。侵入部位に到達した好中球は、そこで病原菌を食べて殺菌を行う。血液中の好中球数が正常の10分の1以下になると、ヒトは無菌室に入らないかぎり生きていけないことからもその重要性は明らかだ。
病原菌が体内に侵入すると、菌に由来する化学物質あるいは生体が菌に反応して生成する化学物質を好中球が感知し、好中球はそれに向かって移動を始める。このような化学物質を感知して、その発生源に向かって細胞が遊走する過程を「ケモタキシス(走化性)」という。ケモタキシスが有効に行われるには、細胞の運動性が高まると共に運動の方向を保つことが必要になる。運動性を高める分子メカニズムについてはすでに多くのことがわっていたが、実は運動の方向を保つ仕組みについてはほとんどわかっていなかった。
実験では、まずmInscを持たない好中球を作出し、この好中球は病原菌に由来する走化性因子によって運動性は高まるものの、そこに向かって真直ぐに動き続けることができないこと(運動の方向を維持できないこと)が判明。すなわち、好中球が遊走する時に形成された前後軸(前後方向の細胞極性)を正しく維持するのに、mInscが必要なことが見出されたのである。
また、好中球は細胞膜にある受容体タンパク質(レセプター)を使って走化性因子を感知するが、mInscが受容体タンパク質と細胞内の極性維持装置をつなぐ働きを持っていることも明らかとなった。
画像は実際の好中球の顕微鏡写真で、刺激前すなわち休止時の好中球は丸い形をしている。マイクロピペットの先から出てくる走化性因子に反応して好中球は形を変え、前後軸ができる。すなわち、前が幅広く後は先細った形になり、この状態が前後方向の細胞極性ができた状態だ。
mInscは、この遊走中の好中球の前部に集まって、前後方向の細胞極性を保つ役割を果たし、好中球が目的地に真直ぐに到達できるようにする。このように、好中球が病原菌に素早く到達し速やかに殺菌を行うために、mInscは重要な働きをしているというわけだ。
今回明らかとなった好中球の遊走における分子機構は、将来は、実際の臨床の場において細菌感染症や真菌感染症に対する治療法の選択や新規な治療法の開発のための基礎となると期待されるとする。
また、ほかの細胞による遊走のメカニズムを解明するための研究への展開も期待できるという。昔から、アメーバなどの単細胞生物が活発に動き回ることはよく知られていたが、「多細胞生物」の体内には、好中球以外にも、組織内を移動(遊走)し場所を変えて活動する細胞が存在する。例えば、神経発生の過程では、ある種の神経細胞はしかるべき場所まで脳内を移動することが必要だ。今回の研究は、好中球にとどまらず、例に挙げた神経細胞などほかの重要な細胞が遊走するメカニズムを解明するためにも役立つと考えられるとしている。