東京大学は5月9日、熊本大学との共同研究により、オスマウスが分泌するペプチド性のフェロモン「ESP1(Exocrine gland-secreting peptide1)」の立体構造を「核磁気共鳴分光法(NMR)」を用いて明らかにし、同フェロモンの受容体であるGタンパク質共役型受容体「V2Rp5」と相互作用する部位を明らかにしたと発表した。
成果は、熊本大大学院 生命科学研究部 構造生命イメージング分野の吉永壮佐助教(同等筆頭著者)、同・博士課程の平金真氏、 同・江崎芳研究員(当時)、同・学部生の濱口貴史氏、同・寺沢宏明教授、東大大学院 農学生命科学研究科 応用生命化学専攻の佐藤徹特任研究員(当時、同等筆頭著者)、同・𡌶紗智子特任研究員(当時)、同・博士課程の角田麻衣氏、同・東原和成教授、同・大学院 新領域創成科学研究科 先端生命科学専攻 博士課程の木本裕子氏(当時)、同・大学院 薬学系研究科 機能薬学専攻 生命物理化学教室の嶋田一夫教授らの研究チームによるもの。研究の詳細な内容は、4月10日付けで「Journal of Biological Chemistry」に掲載された。
ESP1は成熟したオスマウスの眼窩外涙腺で作られて涙に分泌され、メスの性行動を促進させる分子量約7kDaのフェロモンだ。メスがオスと直接接触すると、オスの顔や手についたESP1が、メスマウスの鼻腔の下方に位置する第二の嗅覚器である「鋤鼻器官」に取り込まれる。
その鋤鼻器官とは「ヤコブソン器官」とも呼ばれ、両生類からほ乳類まで幅広い四肢動物で見られる器官だ(ヒトを含む高等霊長類では機能していない)。鼻腔と口蓋の両方に開口しており、フェロモンなど性行動や社会行動に関わる物質を取り込み感知するという機能を持つ。
そして、ESP1によって鋤鼻神経が活性化すると、その情報は脳の扁桃体や視床下部に伝わって、メスは交尾受け入れ態勢である「ロードシス」(メスが背中をそらしてオスの交尾を受け入れやすくする体勢を取る本能的な行動)という性行動を取る。ESP1があると、交尾の確率が3-4倍上昇することから、ESP1はマウスの繁殖に重要な性フェロモンと考えられている。
ESP1は、鋤鼻器官に発現する300種類ほどの鋤鼻受容体の内、V2Rp5という受容体の1つによって感知される。V2Rp5はN末端が長い「グルタミン酸受容体」と同じクラスCファミリーに属する「Gタンパク質共役型受容体」だ。同受容体は、細胞膜を7回貫通する構造を持ち、細胞外の神経伝達物質、ホルモン、匂い、味などを受容して、シグナルを細胞内に伝える仕組みを持つ。その際、Gタンパク質という三量体のタンパク質を介してシグナルを伝達することから、このように名付けられたというわけだ。
なお、このV2Rp5をノックアウトしたマウスではESP1によるロードシス行動が消失することから、ESP1とV2Rp5の相互作用は、ESP1が引き起こすロードシス行動に必要十分なものと考えられるという。
今回の研究では、ESP1とV2Rp5の構造的知見を得るために、NMRを用いて、ESP1の立体構造を明らかにし、さらに部位特異的変異解析によって、ESP1の配列の中で、V2Rp5を活性化するのに重要なアミノ酸残基を同定した。NMRは核磁気共鳴を用いて分子の構造などの性質を調べることができ、低分子から比較的小さいタンパク質まで、立体構造を明らかにすることができる分析手法だ。
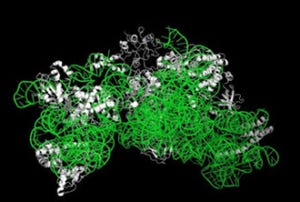
ESP1は、1つの「ジスルフィド結合」(共有結合の1種)と3つの「ヘリックス」(タンパク質の2次構造の1種)からなる比較的コンパクトな構造を持ち、マウス尿主要タンパク質「MUP」など、これまで知られていたフェロモン候補タンパク質の構造とは異なり、アメフラシや単細胞繊毛虫のフェロモンに似た構造を持つことが判明した(画像1・2)。

|
|
|
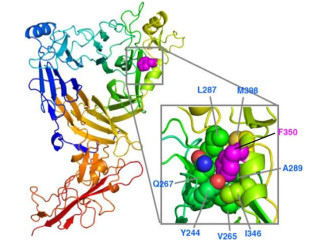
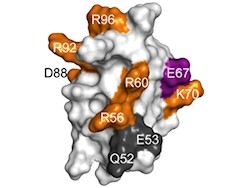
画像1(左)は、ペプチド性フェロモンESP1の立体構造(リボンモデル)。3つのヘリックス(緑)とジスルフィド結合(黄色)からなる。画像2(右)は、部位特異的変異導入実験によって同定した活性部位を示したESP1の電子雲モデル。重要な活性部位(E67、紫)、活性に関わっているアミノ酸(オレンジ)、活性に関わらないアミノ酸(灰色)が色分けされている |
|
さらに、表面が電荷に富んでおり、その内の67番目のグルタミン酸に変異を導入すると、鋤鼻神経活性が顕著に減少したことから、E67がV2Rp5との相互作用に関わるアミノ酸であることが示唆されたのである。そこで研究チームは、グルタミン酸受容体の立体構造を基にV2Rp5のN末端領域のモデル構造を構築し、グローブの様な隙間にESP1を配置してドッキングシミュレーションを実施。すると、サイズと電荷の相互作用的に、結合部位として整合性のある結果が得られたというわけだ(画像3・4)。

|

|
|
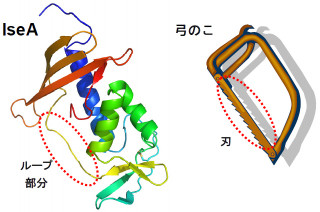
ESP1(画像3:左)とその受容体であるV2Rp5の結合モデル(画像4:右)。グルタミン酸受容体の立体構造を元に、ESP1の受容体であるV2Rp5のN末端側の細胞外領域をモデル構築し、ESP1の結合部位を予測した。ESP1(緑)はV2Rp5のグローブ形の隙間に結合すると予測される。電荷を色分けしてあるが(青:+、赤:-)、ESP1とV2Rp5の結合表面では電荷の相補的相互作用が見られた |
|
今回の結果は、ほ乳類におけるペプチド性フェロモンとその受容体の構造的知見としては初めてものであり、グルタミン酸受容体を含むクラスCのGタンパク質共役型受容体と、ペプチド性の「リガンド」(特定の受容体に特異的に結合する物質のこと)との相互作用に関して新たな情報を提供するものでもあると、研究チームはいう。
また、ESP1の相同ペプチドがマウスゲノム上に38種類、ラットゲノム上に10種類存在する。このESPペプチドファミリーは、性行動や社会行動などさまざまなげっ歯類の行動に関わっていることが推測されており、今回の研究で明らかになったフェロモン‐受容体相互作用の構造的知見は、ネズミの行動を制御する物質のスクリーニングや開発のきっかけになると期待されるとした。