科学技術振興機構(JST)と慶應義塾大学は1月10日、マウスの脳内で生成されている一酸化炭素(CO)が、脳梗塞などの低酸素時の脳血管拡張反応と脳のエネルギー代謝の維持に重要な働きをしていることを発見したと発表した。同発見は慶應義塾大学医学部の末松誠教授と梶村眞弓専任講師らの研究グループによるもので、成果は、米科学誌「米国科学アカデミー紀要(PNAS)」のオンライン速報版にて、米国東部時間で2012年1月9日の週に公開される予定。
ガス分子は極小分子で、タンパク質をはじめとする生体高分子のすき間に入り込み、結合することによってその機能を変化させる機能を持つ。例えば、ヘム(2価の鉄原子とポルフィリンからなる錯体で、ヘモグロビン、ミオグロビン、薬物代謝酵素(P450)、カタラーゼ、一酸化窒素合成酵素、ペルオキシダーゼなどのヘムタンパク質質の補欠分子族)の鉄原子部分にガスが結合することによって、ヘモグロビンのようなヘムタンパク質の機能を変えるのはその典型例だ。
研究グループが行っている、JSTの課題達成型基礎研究(戦略的創造研究推進事業ERATO型研究)の一環である「末松ガスバイオロジープロジェクト」では、こうしたガス応答性のナノスイッチ分子が、ヒトの体内で「いつ、どこで、どのように」して作られ、どのような「未知の働き」をしているのかが探究されている。
ヒトの生存に不可欠なガスというと、多くの人がまず酸素を思い浮かべるはずだ。一方で、一酸化炭素(CO)や硫化水素(H2S)などと聞いたら、大量に取り込むと死亡する可能性のある毒ガスとして認識されているはずである。しかし、これらのガスは肝臓や脳の細胞の中で恒常的に作られている「ガスメディエータ」なのである。COやH2Sは、生体内で血管を収縮あるいは拡張させることで血流を制御したり、抗炎症など有用な生理作用を発揮したりすることが判明しつつあり、少量ながら生体に必要なガスであることが分かってきた。ただし、そのメカニズムは不明な点が多いのも現状だ。
現在までに、脳では多量のCOが恒常的に作られていることは判明しているが、その生理学的役割は不明である。今回の研究では、脳組織が脳梗塞などの低酸素状態になると、酸素(O2)を原料にしてできるCOの濃度が低下することが、低酸素時のリスクマネジメントの根本機構なのではないかと考察。
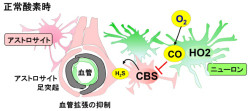
そこで、O2(第1のガス)を利用してCO(第2のガス)を生成している「ヘムオキシゲナーゼ(HO)」(ヘムをCOとビリベルジン、遊離鉄(Fe2+)に分解する酵素)、さらにそのCOと結合するタンパク質としてH2S(第3のガス)の産生酵素であるシスタチオニンβ合成酵素(CBS)に着目した。
H2Sは、脳では血管を拡張させる働きがあることから、低酸素時に起こるCOやH2Sの量的変動が、脳実質内の微小血管の口径や、脳のエネルギー代謝をどのように制御しているのかを検証したのである。
脳神経は、数分の虚血状態でも死に陥るという、「酸素がない状態に非常に弱い」ことが特徴だ。脳がそうした緊急事態に対応するためには、ゆるやかなメカニズムによる応答では間に合わないことから、別のメカニズムがあると考えられている。
しかし、低酸素になって数分以内に起こる非常に速い応答の仕組みがこれまではわかっていなかった。そこで、研究グループが着目したのが、シスタチオニンβ合成酵素(CBS)だ。CBSはホモシステインとシステインの縮合により、シスタチオニンと硫化水素を生成する反応を触媒する酵素である。そして、数分という短時間の低酸素状態にも即時に応答しエネルギー代謝を維持する仕組みとして、そのCBSを中心とした「CO-CBS-H2S」の関係に着目した次第だ。
そして研究グループが発見したのが、正常な脳組織において神経細胞や血管内皮細胞で豊富に生成されているCOによる、CBSの働きを阻害し、血管拡張性ガスとして知られているH2Sの生成量を抑制する効果である。マウスを用いた実験によって、この仕組みが正常時には微小血管が恒常的に少しだけ収縮していることを確認した。
ところが、低酸素状態に陥ると、O2の不足によって、COの産生量がただちに低下することが判明。これは、神経細胞(ニューロン)や血管内皮細胞に発現している酵素「構成型ヘムオキシゲナーゼ(HO-2)」が、酸素が足りないことでCOを生成できなかったためである。つまり、HO-2は脳組織での「酸素センサ」として機能することを示した形だ。
さらに、島津製作所の協力により、精密質量分析技術を利用した新規のH2S測定法を構築して実験を行った結果、低酸素下の脳組織では、COによる恒常的なCBSの活性阻害はCOの低下により速やかに解除され、H2Sが増加することが突き止められた(画像1・2)。これは、低酸素に対する生体防御機構として「ガスが代謝酵素を制御し、別のガスを調節する新しい機構」が存在すること意味しているという。
また、「HO-2の欠損マウス」(COの基礎産生量が低下しているマウス)を用いて、真核生物におけるエネルギー源である「アデノシン3リン酸(ATP)」などのエネルギー代謝物の分布と局所濃度を質量分析イメージングによって検証したところ、正常酸素の状態では、HO-2欠損マウスの脳は、野生型(COの基礎生産量を低下させていないマウス)と比べて、ATPのレベルが増加していることが判明。
ところが、一度低酸素になるとHO-2欠損マウスのATPレベルは極端に低下するのに対し、野生型のマウスではATPは若干減少するものの、比較的維持されているという対照的な結果が得られた(画像3)。
これらの結果から、中枢神経系で生成されるCOは、急激な酸素の供給低下にうまく対応できるように、血管拡張性や脳のエネルギー産生の「予備能」(正常時は少し抑え気味、しかしピンチになった時は、より効果的に血流を増加させたり、エネルギーを産生したりする能力)を与えるガスメディエータであることが明らかになったのである。
なお研究グループは、次の課題として、近年、脳の局所で神経機能が活発になった時に起こる局所血流の増加「ファンクショナルーハイパーエミア」のメカニズムに対する、今回の成果との関連を検討しているという。
ファンクショナルーハイパーエミアは秒単位という非常に速い反応速度で起きるのが特徴だが、その生化学的な仕組みは不明だ。局所の神経機能活動が活発な時はその部位の代謝が活発化し、細胞内外のガス環境も瞬時に変化すると予想できることから、今回発見された複数のガスが織りなす情報伝達機構が、ファンクショナルーハイパーエミアを引き起こす仕組みに寄与しているか否かを今後の研究では採り入れていきたいとしている。
さらに、「ガス分子の生体内作用点の実態」を解明することにより、脳循環障害や神経疾患の病態を理解し、治療のターゲットを絞りこむための布石とすることも検討しているという。その理由としては、脳で消費されるO2はATPを産生するためだけでなく、さまざまな血管作動性物質を産生する原料となるからである。
従って、虚血に起因する組織低酸素により起こる組織内ガス分布のリモデリング(再構築)や、ガスシグナリング(ガスによる情報伝達)の変化のメカニズムに対する理解を深めることは、治療の第一歩であるという。
転写・翻訳による制御は、新たにタンパク質を合成するため、時間のかかる仕組みだ。今回発見されたガス分子による制御は、数分以内の応答が可能な低酸素病態の防御機構の一端である。研究グループは今回の成果に対し、脳梗塞などの脳循環疾患の制御や救急蘇生学の最適化などの臨床医学研究への展開が期待されるとしている。