東京大学は、同大大大学院医学系研究科 細胞生物学講座/分子構造・動態学寄付講座の廣川信隆 特任教授、九州大学大学院 歯学研究院の城戸瑞穂 准教授、東京大学大学院医学系研究科 細胞生物学・解剖学講座の武井陽介 准教授、東京大学大学院医学系研究科 細胞生物学講座/分子構造・動態学寄付講座の尹喜玲 特任研究員らの研究チームが、分子モーター「KIF17」が欠損したマウスの解析により、KIF17が、グルタミン酸受容体NR2Bを神経細胞樹状突起内で輸送するだけでなく、NR2Bおよび自身(KIF17)のmRNAの合成を、転写因子CREBを介して制御し、かつグルタミン酸受容体NR2Aのユビキンプロテアーゼを介した分解も制御することで、記憶・学習の基盤となっていることを解明したことを明らかにした。米国科学雑誌「Neuron」に掲載された。
細胞はその機能に必要なさまざまな物質を、微小管のレールの上を走る分子モーターを使った物質輸送メカニズムによって、細胞の隅々にまで運んでいる。NMDA受容体は、グルタミン酸に結合して働く受容体であり、動物の記憶や学習に深く関わりを持つことが知られているが、NMDA受容体の輸送が脳や神経の機能にどのような意味を持つのか、ほとんど不明のままであった。
今回、研究チームは、キネシンスーパーファミリータンパク質「KIF17」分子モーターがNMDA受容体の輸送を行うだけではなく、その量を調節していることを発見した。
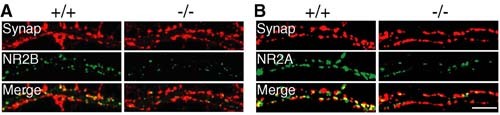
NMDA受容体にはいくつかの種類(サブユニット)があるが、KIF17を欠いたマウスの神経細胞を調べると、サブユニット2Aとサブユニット2Bの量が減り、その結果、マウスの学習能力が著しく低下した(図1)。
さらに詳しく調べると、サブユニット2Aが壊れやすくなっていること、サブユニット2Bの生成量が減っていることが判明した。ただし、神経の働きが盛んになるとKIF17とNMDA受容体の量がともに増え、運ばれるNMDA受容体の量も増大する。
この発見で重要なことは、KIF17が単にNR2Bを輸送しているだけでなく、NR2Bおよび、KIF17自身の遺伝子mRNA の転写を制御していることが解明されたことにあり、このことで、勉強すればするほど頭が良くなるという説の根拠が解明されたこととなる。
なお、研究チームでは、このようなKIF分子モーターによる脳・神経機能の調整機構は、将来、神経疾患の治療法への新しいアプローチとなることが期待されると説明している。