ローレンス・バークレー国立研究所らの研究チームは、マグネシウム二次電池の性能劣化に関する新しい発見をしたと発表した。これまで充電動作中に起こると考えられてきた電池の劣化現象が、実際には充電を行う以前の静止状態でも起こっていることを突き止めたという。今後の二次電池の設計・開発に役立つ知見であるとしている。研究論文は「Chemistry of Materials」に掲載された。
商用化されているリチウムイオン電池では負極側の電極にグラファイトなどの炭素材料が使われている。しかし炭素が吸蔵できるリチウムイオンの数には限界があるので、電池容量を上げるために炭素よりも多くのリチウムイオンを吸蔵できる負極材料の開発が進められている。
有力な候補材料のひとつはリチウム金属負極だが、リチウム金属は空気との反応性が非常に高く、安全性確保のための封止技術が必要であり実用化には至っていない。
また、マグネシウム金属負極は、リチウム金属負極よりもリチウムイオンを多く吸蔵できる材料であり、こちらも高エネルギー密度を実現できる負極の候補材料として研究されている。マグネシウムはエネルギー密度が高いだけでなく、リチウムと比べて空気中での安定性が高いという特徴がある。
これは空気中の水分と酸素がマグネシウムと反応することで、マグネシウム表面に酸化層が形成され、一種の保護膜として働くためであるとされる。ただし、この保護膜は、電池の内部では電池の効率を下げたり、寿命を短くしたりする要因になっていると考えられている。このため研究者の間では、電池内での酸化層形成を防ぐ方法が探されている。
研究チームは今回、マグネシウム表面での酸化層形成を詳細に調べるために、大気圧X線光電子分光法(APXPS:ambient pressure X-ray photoelectron spectroscopy)と呼ばれる手法を用いて、電極表面と電解液の界面で生じる化学反応を観察した。
その結果、テスト用電池に電流を流すより前から、マグネシウム負極との界面で電解質の化学的分解が起きていることを示唆するデータが得られたという。この電池に使われた電解質の成分は溶媒のジグリムにMg(TFSI)2を溶解させたものであり、この電解質とマグネシウム金属負極の組み合わせは、これまで電池の休止状態には反応が起こらず安定していると考えられてきたものだった。

|
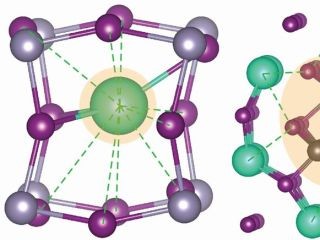
浮遊する水酸化物イオンによって電解液の分子結合が弱まることを示すシミュレーション画像。水素原子は白、酸素原子は赤、炭素原子は水色、マグネシウム原子は緑、窒素原子は青、硫黄原子は黄色、フッ素原子は茶色で表されている(出所:バークレー研究所) |
このように予想に反して休止中の電池内でも劣化が進む理由を突き止めるため、さらに詳細な分析を行ったところ、わかってきたのはマグネシム表面に形成される酸化層には欠陥と不純物が存在しており、この欠陥と不純物によって劣化原因となる反応が引き起こされているらしいということだった。
スーパーコンピュータによるシミュレーションからは、マグネシウム表面の酸化層にある欠陥によってマグネシムイオンが露出され、これが電解質分子を捕獲するトラップとして働いていることがわかってきた。微量の水分がマグネシウム金属と反応することで水酸化物イオンが生成され、この水酸化物イオンが浮遊してマグネシウム表面にトラップされた電解質分子と出会うと、そこでさらに反応が起きる。この反応によって電解質が浪費され、電池の劣化が進んでいくと考えられている。
このような反応は、マグネシウム金属以外の材料(リチウム金属やアルミニウム金属など)を使った電池にも広範にみられる一般的現象である可能がある。研究チームは、この種の反応による不安定性を低減するには電解質をどのように改良すればよいかを示すため、新たなシミュレーションをはじめているという。