順天堂大学は6月22日、パーキンソン病の一種であるペリー(Perry)症候群でみられる神経軸索変性による神経機能不全を改善する方法を開発したと発表した。
同成果は、順天堂大学大学院医学研究科神経学 服部信孝教授、パーキンソン病病態解明研究講座 今居譲先任准教授らの研究グループによるもので、6月9日付けの国際医学誌「EBioMedicine」オンライン版に公開された。
ペリー症候群は、パーキンソン病で特徴的な運動症状のほか、うつや無気力などの精神症状、呼吸機能の低下を呈し、最終的に突然死を起こす難治性の遺伝性神経変性疾患。ドーパミン神経が変性することから、ドーパミンを補充する治療で症状は改善するが、進行性の病気でありこれを止める治療法は見つかっていない。
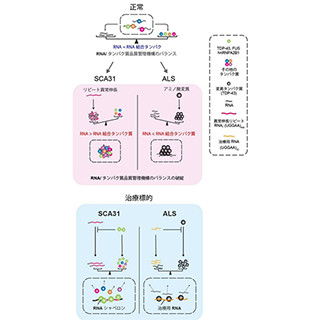
これまでの研究で、原因遺伝子は逆行性の神経軸索輸送に関わるDCTN1であること、病変部位である大脳基底核の神経細胞にTDP-43が蓄積することが明らかになっている。TDP-43は、RNAとタンパク質の複合体を形成する機能未知のタンパク質で、筋萎縮性側索硬化症(ALS)やアルツハイマー病においても病変部位で異常な蓄積がみられる。しかし、なぜ大脳基底核にTDP-43が蓄積するのか、TDP-43の蓄積が病態にどのように影 響するのかは明らかになっていなかった。
今回、同研究グループは、DCTN1の変異を神経細胞に導入したペリー症候群疾患モデルショウジョウバエ(ペリーモデル)を作製した。ペリーモデルは、神経の機能不全からくる運動障害を示し、寿命の短縮がみられたため、詳細に解析したところ、逆行性の神経軸索輸送が顕著に障害され、神経終末構造の肥大が起こっていることが明らかになった。さらに、逆行性の神経軸索輸送が滞ることによって、有芯小胞が凝集化し、その結果ドーパミンの分泌が低下することもわかった。
次に、TDP-43の遺伝子をひとつ減らしたところ、TDP-43の遺伝子から作られるTDP-43タンパク質量が30%程度低下したため、この状態でペリー症候群に関連する神経症状が変化するかどうかを調べたところ、運動機能の改善と寿命の伸長が認められた。また、逆行性の軸索輸送と有芯小胞の凝集化が改善し、ドーパミンの分泌も回復した。
これらの結果から、DCTN1の変異によりドーパミンを備蓄する有芯小胞の輸送が滞って凝集化し、ドーパミンの分泌が低下することが明らかになったと言える。また、TDP-43の発現をコントロールすることで病気の進行を抑えることができる可能性が明らかになった。同研究グループは、今後臨床応用のための研究を進めていくとしている。