理化学研究所(理研)は12月2日、がん細胞の運動を制御する新しい仕組みを発見したと発表した。
同成果は、理研 吉田化学遺伝学研究室 吉田稔主任研究員、伊藤昭博専任 研究員、統合生命医科学研究センター 医科学数理研究グループ 角田達彦 グループディレクター、産業技術総合研究所 創薬分子プロファイリング研究センター 夏目徹 センター長、東北大学大学院医学系研究科 医科学分野 山本雅弘 教授らの研究グループによるもので、11月24日付けの米科学誌「Science Signaling」オンライン版に掲載された。
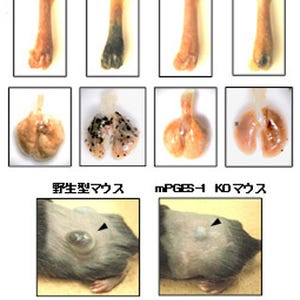
がん細胞の浸潤および転移に関わる重要な因子である「コータクチン」という、細胞質に存在するタンパク質は、がん転移治療の標的分子として着目されている。コータクチンの活性は、アセチル化などの翻訳後修飾により制御されていることが知られていたが、その詳細なメカニズムについては明らかになっていなかった。
今回の研究では、コータクチンのアセチル化修飾酵素を調べている過程で、コータクチンが細胞核と細胞質を行き来するシャトルタンパク質であることが明らかになった。また、コータクチンの新しい結合パートナーとして酸化ストレス応答転写因子Nrf2の負の制御因子であるKeap1を発見。このKeap1はコータクチンを細胞質にとどめおき、外部シグナルに応答して細胞辺縁部へ運ぶことにより、細胞の運動を増進するという機能を持つことがわかった。この際に、コータクチンがアセチル化されているとKeap1との結合が弱くなるため、がん細胞の動きが著しく低下することも明らかになった。
この結果から、Keap1とコータクチンの相互作用を阻害することで、がん細胞の浸潤や転移を抑えられるということが示されたといえる。また、コータクチンのアセチル化はKeap1との結合を弱めるため、コータクチン脱アセチル化酵素の阻害剤はがん転移の治療薬になる可能性がある。
理研は今後、コータクチン脱アセチル化酵素を標的とした創薬の開発が期待されるとしている。