東京都医学総合研究所(東京都医学研)は、徳島大学、名古屋大学(名大)、静岡大学、産業技術総合研究所(産総研)、京都産業大学(京産大)、JST-CREST、カナダ・マギル大学との共同研究により、リン酸化された「ユビキチン」(細胞内に存在する小さなタンパク質)が、「遺伝性パーキンソン病」の発症を抑えるために働く分子であることを明らかにしたと発表した。
成果は、都医学研 タンパク質リサイクルプロジェクトリーダーの松田憲之副参事研究員、同・佐伯泰副参事研究員、同・田中啓二所長、徳島大 藤井節郎記念医科学センターの小迫英尊 教授、名大 物質科学国際研究センターの田村康 准教授、静岡大 農学研究科の木村洋子教授、産総研 創薬分子プロファイリング研究センターの広川貴次チームリーダー、JST-CRESTおよび京産大 生命システム学科の遠藤斗志也 教授、マギル大のEdward Fon博士、同・Jean-Francois Trempe博士らの国際共同研究チームによるもの。研究の詳細な内容は、現地時間4月30日付けで英科学誌「Nature」オンライン版に掲載された。
パーキンソン病は、神経伝達物質である「ドーパミン」を産生する神経細胞が失われることにより、安静時のふるえや歩行障害(すり足、小股、前屈姿勢など)、姿勢保持障害(例えば歩き出したり後方に引かれたりすると、止まれずに突進してしまう)、動作緩慢(動きが遅くなったり少なくなることで、細かい作業が困難になる)など、さまざまな運動障害が起こる病気だ。病状が進行すると自律神経障害、記憶力低下などの認知機能障害、幻視やうつなどの精神症状が現れることもあり、最終的には自立した生活が困難となって、車いすや寝たきりの生活になる危険性がある。
パーキンソン病は日本国内だけでも15万人を超える患者がいる難治性の神経変性疾患だ。高齢者ほど患者数が多く、65歳を超えると1%以上の人が罹患するといわれている。社会の高齢化が進むにつれて患者数は増え続けており、病気が発症する仕組みの解明と、早期診断法や根本的な治療法の確立が社会的に強く求められている状況だ。
パーキンソン病にはいくつかのタイプがあり、大きくは孤発性(患者の8~9割を占めるとされる)のものと、遺伝性のもの(「遺伝性パーキンソン症候群」とも呼ばれる)に分けられ、発症原因も単一ではない考えられているという。また全体の1~2割を占める遺伝性のものは、病気の原因が単一遺伝子の変異であり、病気と発症原因の因果関係がはっきりとしている。
その1つに「遺伝性若年性パーキンソン病」があるが、これは遺伝子の「PINK1」や「Parkin」、ならびにその遺伝子によって作られるPINK1タンパク質やParkinタンパク質が変異すると、パーキンソン病を若くして発症してしまうというものだ。
遺伝子の変異によってPINK1やParkinの機能が失われると発症するので、これらの遺伝子は「パーキンソン病の発症を抑えるために働いている」ことがわかっている。PINK1は標的となるタンパク質にリン酸を付加する「タンパク質リン酸化酵素(プロテインキナーゼ)」で、Parkinは標的タンパク質にユビキチンを付加する「ユビキチン連結酵素」だ。
なお、リン酸化とは、「リン酸(化学式H3PO4)」をタンパク質につけることをいい、逆に外すことを「脱リン酸化」というが、細胞内での情報伝達を担っている。リン酸を別の物質につける働きを持つタンパク質をリン酸化酵素(キナーゼまたはカイネース)という。
そしてユビキチンは、細胞内においてほかの標的となるタンパク質に結合(修飾)することで機能する小さなタンパク質だ。酵母やハエなどから、ヒトに至るまで多くの生物が持つ。このユビキチンが結合することでその標的のタンパク質を分解に導く「細胞内分解シグナル」としての機能がよく知られている。
田中所長はユビキチンが結合したタンパク質を分解する酵素「プロテアソーム」の発見者で、これまで松田プロジェクトリーダーらとの研究で、「PINK1とParkinの機能を調べればパーキンソン病の発症機構に迫れるのではないか」と考察して10年近い研究を続けている。その結果、2010年にはPINK1とParkinが協調して細胞小器官「ミトコンドリア」(生物に必要なエネルギーのATP(アデノシン三リン酸)を産生する構造体)の品質を維持するために働いていることを突き止め、2012年にはPINK1が自分自身をリン酸化することがミトコンドリア異常を伝える最初のできごとであることを発見している。
しかし、PINK1とParkinの両者を結びつける分子の実体がこれまで確認されておらず、最大の謎とされてきた。その「ミッシングリンク」の発見・同定こそがこの分野に残された課題だったのである。そこで研究チームは今回、そのミッシングリンクの発見に挑んだというわけだ。
そして遂にそのミッシングリンクが発見され、細胞がパーキンソン病の発症を抑える仕組みを解明するに至ったというわけだ。研究チームは、細胞内でミトコンドリアの品質が低下した時に、PINK1キナーゼがユビキチンをリン酸化し、このリン酸化ユビキチンがParkinを活性化することで遺伝性パーキンソン病の発症を抑えていることを解明したのである。つまり、PINK1が細胞の中で「このミトコンドリアが異常だ」という情報をどのようにして伝達するのかを、「ユビキチンのリン酸化」という分子のレベルで解明したというわけだ。
遺伝性パーキンソン病の患者由来のPINK1(患者の変異を有するPINK1)はユビキチンをリン酸できないため、Parkinを活性化することができない。この経路が障害されると、どのミトコンドリアが不良品であるかという情報が細胞の中で正しく伝わらず、異常なミトコンドリアが処分されないために、脳内のミトコンドリアの品質が低下して、パーキンソン病が発症すると考えられるという。つまりリン酸化ユビキチンは遺伝性パーキンソン病の発症を抑えるために働く分子なのである。
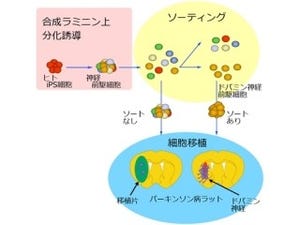
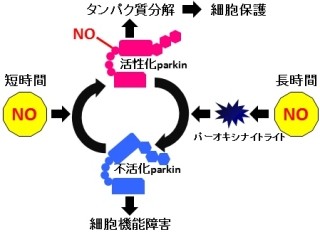
画像は、今回の研究で明らかにされたリン酸化ユビキチンの機能を表した模式図だ。正常な状態では、PINK1がユビキチンをリン酸化してParkinを活性化することで、細胞内の異常なミトコンドリアが除去されるのは前述した通りだが、この機構が破綻すると異常なミトコンドリアが脳内に徐々に蓄積し、パーキンソン病の発症に至る。
なお、Parkinが結合するユビキチン(画像の右側)は、必ずしもリン酸化されている必要はない。ただし、PINK1→リン酸化ユビキチン→Parkinの活性化→ユビキチンがミトコンドリア上に集積→そのユビキチンをPINK1がさらにリン酸化→Parkinの活性化……という正のサイクルが形成されて、それがシグナルを増幅させていると予想されるという。
ユビキチンに関してはすでに1万報以上の論文が報告されているが、ユビキチンのリン酸化やその生理的な意義が示されたのは今回が初めてだという。また今回の研究を通じて、リン酸化ユビキチンがPINK1とParkinを結びつけるカギ因子であることが明らかにされたことから、遺伝性パーキンソン病の発症メカニズムの理解が飛躍的に進んだ形だ。今回の成果は遺伝性パーキンソン病に関するものだが、より一般的な孤発性パーキンソン病についても同様の仕組みが発症に関与している可能性は十分にあるとする。
さらに今回の成果は、パーキンソン病に関する新しい病理解析ツールや診断マーカーの開発につながると考えられるという。今回の成果によってPINK1によるユビキチンのリン酸化部位が決定されていることから、そのリン酸化ユビキチンに由来する信号を質量分析装置でとらえることによって、放置するとパーキンソン病の発症につながるような「細胞内のミトコンドリア異常」を知らせる信号を高感度で検知することが期待できるとする。
ただし、すぐさまパーキンソン病の治療薬が開発されるかというとそうではなく、将来的にはパーキンソン病の治療薬におけるスクリーニングへの応用も期待されるが、長期的な視野で考えなければいけない課題であり、10年程度の長い時間がかかることが予想されるとした。