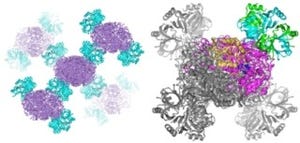
東京大学は1月22日、活性酸素によって誘導される細胞死や免疫応答を促進する細胞内の「シグナル伝達分子」であるタンパク質「ASK1」の分解を促進させる新たなユビキチン化酵素タンパク質「Roquin-2」を発見したと発表した。
成果は、東大大学院 薬学系研究科 薬科学専攻細胞情報学教室の一條秀憲 教授、同・松沢厚特任准教授、同・丸山剛 特任研究員(当時)らの研究チームによるもの。研究の詳細な内容は、日本時間1月22日付けで「Science Signaling」オンライン版に掲載された。
活性酸素とは、「スーパーオキシド」、「ヒドロキシラジカル」、「過酸化水素」、「一重項酸素」など、酸素に由来する反応性の高い分子の総称のことをいう。ミトコンドリアでのエネルギー産生や細胞膜での酵素反応などによって生体内では常に生成されている。そして生体内で活性酸素が過剰に産生されてしまうと、生体を構成するタンパク質やDNA、細胞膜などが損傷を受ける可能性があり、活性酸素によって修復できないほど細胞が障害を受けると、細胞死が誘導される仕組みだ。
このような活性酸素によって誘導される細胞死は、心筋梗塞や脳梗塞といった虚血性疾患や神経変性疾患、糖尿病、がんなどさまざまなヒトの疾患に関与することが知られていた。また過剰な免疫応答は、強いアレルギー反応や炎症を引き起こし、ぜんそくや皮膚炎、リウマチなどの自己免疫疾患につながってしまう。しかし、このような細胞死や免疫応答が、どのような仕組みによって調節されているかについては、不明な点が残されていたのである。
研究チームはこれまで、ASK1が活性酸素誘導性の細胞死や免疫応答を促進すること、ASK1が活性化されるとそれに伴ってASK1が「ユビキチン化」され、分解されることも見出していた。ただし、ASK1のユビキチン化に関与する分子やユビキチン化の仕組みについてはまだ明らかになっていなかった。そこで、研究チームは今回の研究でも引き続きASK1に注目。そして、その分解を促進させる新たなタンパク質を同定し、細胞死や免疫応答を適切に調節する仕組みを見出したというわけだ。
なお、ASK1などのシグナル伝達分子とは、細胞内外のさまざまな環境の変化を感知し、その情報を核や細胞内の小器官へと伝達する一連の分子群のことをいう。また、ユビキチンとは76個のアミノ酸からなる小さめのタンパク質で、ほかのタンパク質の修飾に用いられるという特徴を持つ。タンパク質の分解やDNA修復、小胞膜輸送、シグナル伝達など多様な生理機能に関わっている。特にユビキチンが共有結合によって鎖状に連なった「ポリユビキチン」は、タンパク質分解酵素複合体である「プロテアソーム」によって認識され、分解されるべきタンパク質の目印となることがわかっている。
今回の研究では、具体的に、特定のタンパク質を消失させる「RNA干渉法」を用いた「スクリーニング」によって、ユビキチン化に関わる約1500の遺伝子の中から、このASK1のユビキチン化分解を促進するタンパク質の探索が行われた。RNA干渉法とは、標的とする遺伝子と塩基配列が同じ2本鎖RNAを細胞内に導入すると、標的とする遺伝子のmRNAが分解され、その遺伝子の発現が抑制できる技術のことをいう。またスクリーニングとは、目的とする遺伝子やタンパク質などを、多くの群の中からさまざまな手法を用いて選別・特定する作業のことである。
スクリーニングの結果に発見されたのRoquin-2だ。解析の結果、Roquin-2は、実際にヒトの細胞において、活性酸素の刺激によって活性化したASK1をユビキチン化して分解を促進すること、また活性酸素によって誘導される細胞死を抑制することが確認されたのである。さらに、実験に広く用いられている原始的なモデル生物である「線虫」において、Roquin-2がASK1を分解することによって、細菌に対する免疫応答が調節されていることも見出された。
これらの結果は、Roquin-2がASK1のユビキチン化分解を介して、活性酸素による細胞死や免疫応答を調節するタンパク質であること、またこのRoquin-2によるASK1の分解は、原始的生物である線虫からヒトまで進化的に保存された重要な仕組みであることを示しているという。
以前に研究チームは、Roquin-2とは逆の働きをする、ASK1からユビキチンを外すタンパク質として「USP9X」を同定しており、USP9XがASK1の分解を抑制してその活性を持続させ、活性酸素誘導性の細胞死を促進することを見出していた。その結果も合わせると、生体内で起こるASK1を介した活性酸素誘導性の細胞死や免疫応答は、USP9Xや今回同定されたRoquin-2のバランスによって適切に調節されていることが示唆されたという。
Roquin-2は、過剰な細胞死や免疫応答を原因とする虚血性疾患や神経変性疾患、炎症や自己免疫疾患など、さまざまなヒトの疾患に対する新たな治療標的となることが期待されるとしている。