京都大学は10月17日、ヒトの「皮膚線維芽細胞」からiPS細胞を経ずに「軟骨細胞様細胞(induced chondrogenic cell:iChon(アイコン)細胞)」へと直接変換する「ダイレクト・リプログラミング」に成功したと発表した。
成果は、京大 iPS細胞研究所(CiRA)の王谷英達研究員(現・大阪大学大学院医学系研究科)、同・妻木範行教授(JST CREST)らの研究チームによるもの。研究の詳細な内容は、米国東部時間10月16日付けで米オンライン科学誌「PLoS ONE」に掲載された。
関節軟骨は軟骨細胞と細胞外物質II型・IX型・XI型コラーゲンおよび「アグリカン」により作られており、関節の滑らかな動きを実現し、またショックを和らげる役割を果たしている。しかし軟骨は再生(修復)能力が低いため、ケガや加齢などを原因として失われていく。損傷を放置すると、広い範囲で「線維化」などの変性が生じ、関節機能への障害や痛みを引き起こしてしまうのだ。
通常関節軟骨は硝子軟骨により構成されているが、損傷すると一部が線維軟骨に置き換わる。線維軟骨はI型コラーゲンを作り、軟骨特有の細胞外物質構造やその機能が失われてしまう。そのため、軟骨の機能を取り戻すためには、線維軟骨を含まない高純度の硝子軟骨を用意し、軟骨が失われた部分に移植するか、線維軟骨をその場で硝子軟骨に変える必要があるというわけだ。
軟骨を作製する方法の1つとして、iPS細胞から誘導する方法が考えられる。また、もしiPS細胞を経ないで線維芽細胞から直接軟骨細胞へと変換することができれば、iPS細胞を使う方法よりも短期間で軟骨細胞が得られると考えられるという。実際に妻木教授らの研究チームは、2011年にマウス皮膚線維芽細胞に2つのリプログラミング(初期化)因子の「c-MYC」と「KLF4」(山中因子4つの内の2つ)、1つの軟骨因子「SOX9」を導入することで、iPS細胞の状態を経ることなくiChon細胞へとダイレクト・リプログラミングできることを報告済みだ。
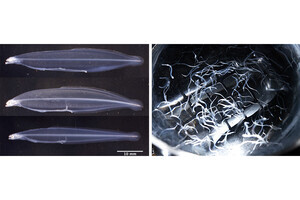
ヒト皮膚の線維芽細胞にレトロウイルスを使って前述した3因子を導入すると、14日後には軟骨細胞に特徴的な細胞塊が生じることが確認された(画像1)。軟骨を青く染めるアルシアンブルーでもって、この塊を染色したのが画像2である。このことからヒトの線維芽細胞がiChon細胞へと分化していることが確認された。
ヒト線維芽細胞から作製したiChon細胞では、線維化した細胞で多く発現しているI型コラーゲンは検出されず、軟骨細胞に特徴的なII型コラーゲンやアグリカンの発現が検出されたのである。これらの遺伝子発現のパターンからもiChon細胞が軟骨細胞に近いことがわかった。画像3がiChon細胞の遺伝子発現パターンを示したグラフだ。
画像3のグラフの「HDF(human dermal fibroblast)」はヒト皮膚線維芽細胞を、「HFC(human fetal chondrocytes)」はヒト培養軟骨細胞。ヒトの軟骨細胞から取り出した細胞を培養したもので、今回の実験では実験が正しくできているかを確認する標準(ポジティブ・コントロール)として利用されている。HFCは培養するとどうしても一部が繊維化してしまい、I型コラーゲンが検出されてしまうという特性がある。また、「COL1A1」および「COL1A2」はI型コラーゲン、「COL2A1」はII型コラーゲン、ACANはアグリカンを示す。
次にヒトiChon細胞が硝子軟骨を作る能力を確かめるために、免疫不全マウスにiChon細胞が移植された。すると、42カ所に移植した内の14カ所で硝子軟骨様組織の形成が確認されたのである。硝子軟骨が形成されている部分の組織観察を行うと、硝子軟骨様の部分は硝子軟骨に特有のII型コラーゲンは見られるものの、I型コラーゲンは見られず(画像4)、iChon細胞から形成された組織は硝子軟骨であることが確認された。
iChon細胞の移植後最長3カ月間の観察も行われたが、腫瘍化は見られなかったという。なお画像4中の「Safranin-O」は軟骨を染める染料(画像中のオレンジ色の部分。紫色は核を示している)のことで、「Vimentin」は細胞骨格タンパク質(移植したiChon細胞が軟骨として生着していることを確認している)だ。
今回の研究により、ヒトの細胞においても線維芽細胞を軟骨細胞へとダイレクト・リプログラミングし得ることが示された。これにより短期間で目的の硝子軟骨を作ることができ、軟骨再生医療において新たな軟骨細胞の供給源になることが考えられるという。ただし、今回用いた方法では腫瘍化に大きな影響を与えるとされるc-MYCを使用しており、またレトロウイルスを用いて遺伝子導入をしている。ヒトの治療に応用するためには、これらの課題を克服する必要があるとした。
また、軟骨の再生という点では、CiRAが現在進めている「iPS細胞ストック」を利用して軟骨細胞を作製することも可能だ。ただしiPS細胞ストックを利用する場合、自家移植ではなく他家移植(同種移植)であるため、拒絶反応などのリスクを検討する必要はある。その一方で、コスト面でのメリットが大きくなるという。
ダイレクト・リプログラミング技術は、線維化した軟骨を生体内で局所的にリプログラミングすることに応用が開ける。そのためには今後、遺伝子導入を伴わない化合物などを用いて、軟骨組織周辺で局所的にリプログラミングを誘導する技術を開発する必要があるという。iPS細胞ストックを用いる方法と、今回のダイレクト・リプログラミングの手法を上手く使い分ける必要があるとした。そして今回見出された手法が、軟骨再生において高純度の軟骨細胞を供給する手段の1つとなること、また軟骨に関連する疾患の病態解明に貢献することが期待されるとしている。