理化学研究所(理研)は9月13日、細胞内のカルシウム濃度を調節するカルシウムチャネル「イノシトール三リン酸(IP3)受容体」が小脳と「脳幹」で機能しなくなると、中枢神経系の難治性障害「全身性ジストニア」を発症することを明らかにしたと発表した。
成果は、理研 脳科学総合研究センター 発生神経生物研究チームの御子柴克彦チームリーダー、同・久恒智博研究員と、同・シナプス分子機構研究チームの宮本浩行客員研究員(科学技術振興機構さきがけ研究員)らの研究チームによるもの。研究の詳細な内容は、近日中に科学誌「Frontiers in Neural Circuits」オンライン版に掲載された。
運動障害、認知症、アルツハイマー病といった脳に関わるさまざまな病気は、情報が脳神経回路上を正しく伝達されない時に発症すると考えられている。この脳神経回路の情報伝達に欠かせない要素の1つが、神経細胞内にあるカルシウムだ。カルシウムは、細胞内の情報伝達物質として非常に重要な働きをしている。しかし、過剰なカルシウムは細胞にとって有害となるため、細胞内カルシウムの濃度を適切に調節することが大切だ。
この濃度調節に重要な役割を果たす分子の1つがIP3受容体である。IP3受容体は、細胞内に存在するカルシウム貯蔵庫である小胞体の膜上にあるイオンチャネルだ。イオンチャネルとは、特定のイオンを透過させる膜タンパク質で、IP3受容体は細胞外からの情報に応じて小胞体から適切な量のカルシウムを細胞内に放出し、濃度を調節している。またIP3受容体には3種類のタイプがあり、脳のさまざまな神経細胞に非常に多く存在しているのがタイプ1型の「IP3R1」だ。
これまでに研究チームは、IP3R1を全身で欠損させた「IP3R1欠損マウス」が、捻転や硬直・「後弓反張(こうきゅうはんちょう)」(頚部を強く背屈させて、全身が後方弓形にそりかえる姿勢のこと)など、てんかんに似た発作を起こすことを明らかにしている。しかし、IP3R1欠損マウスに見られるてんかんに似た発作が、脳のどの領域の神経活動の異常により生じるのか、その発症メカニズムは明らかにされていなかった。一方、中枢神経系の難治性障害である「ジストニア」は、病態の様子から運動の制御に関わる「大脳基底核」の異常活動が発症に関わると考えられてきたが、未だ発症メカニズムについてわかっていない。
研究チームは、IP3R1欠損マウスに見られるてんかんに似た発作を起こす脳部位や神経回路を特定するために、(1)海馬/大脳皮質だけでIP3R1を欠損させたマウス(海馬/大脳皮質KOマウス)、(2)大脳基底核の主要な構成要素である「線条体」だけでIP3R1を欠損させたマウス(線条体KOマウス)、(3)小脳/脳幹だけでIP3R1を欠損させたマウス(小脳/脳幹KOマウス)を作製し、観察した。その結果、(3)の小脳/脳幹KOマウスだけがIP3R1欠損マウスと同様に、てんかんに似た発作を起こしたのである。(1)の海馬/大脳皮質KOマウスと(2)の線条体KOマウスに関しては、明らかな運動障害は見られず、正常だった(画像1~5)。

|

|
|
マウスの脳構造における各脳領域の位置と「プルキンエ細胞」への情報伝達経路。画像1(左):マウスの脳断面図において、プルキンエ細胞層(赤い点線)、「下オリーブ核」(青)、「線条体」(オレンジ)、海馬、大脳皮質、「脳幹」の領域が示されている。図の左側が前方で、右側が後方。画像2(右):下オリーブ核から登上線維を介したプルキンエ細胞への情報伝達経路 |
|
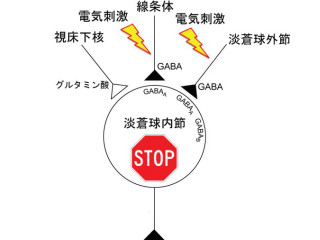
なお部位に関して説明しておくと、まず大脳基底核とは、大脳皮質と視床、脳幹を結びつけている神経核(線条体、「黒質」、「視床下核」、「淡蒼球」)の集まりで構成される領域のことをいう。運動機能と密接な関係があり、大脳基底核の機能異常は、パーキンソン病、ハンチントン舞踏病などの運動障害を起こす。また脳幹とは、延髄と橋(きょう)、中脳と間脳を合わせた領域。生命の維持に関わる呼吸や体温調整、血液循環などの維持に不可欠で、進化の過程において最も古くからある脳部位だ。
線条体は、運動機能学習などの認知機能に関与し、GABA作動性の中型有棘細胞が多くを占めるが、そのほかの抑制性神経細胞も存在する部位。小脳は、歩行などの運動や平衡感覚の調節を担う脳の部位で、運動の学習にも関係。小脳に異常があると円滑な動作ができなくなり、平衡感覚が悪化して歩行障害などを引き起こすこともある。
黒質は中脳に存在するが、大脳基底核の一部として扱われる部位。出力を行う「黒質網様部」と、ドーパミン作動性ニューロンを多く含んでおり、線条体に投射する「黒質緻密部」の2つがある。視床下核は線条体と並んで、大脳皮質からの入力を受け持つ。そして淡蒼球は内節と外節があり、内節は黒質網様部と一体の構造物とされ、視床への出力部を行う。外節は間接路が通る介在部だ。
また画像1中の下オリーブ核は、延髄にある神経細胞群。登上線維と呼ばれる神経線維を伸ばして、プルキンエ細胞へ情報を出力する。そのプルキンエ細胞は小脳皮質に一層に並ぶ神経細胞で、小脳の中で唯一、情報を出力する細胞だ。特徴的な形をした大型の神経細胞で、よく発達した樹状突起を分子層に伸ばし、顆粒細胞の軸索である平行線維と延髄にある下オリーブ核から伸びる登上線維からの情報の入力を受ける。軸索は白質を通って深部小脳核へ接続。
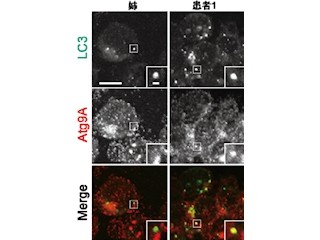
次に研究チームは、神経活動の指標となる遺伝子群「cfos mRNA」の量を調べた。cfos mRNAは神経活動の上昇に応じて早い段階で発現が誘導される遺伝子であり、神経活動のマーカーとなる。そしてcfos mRNAの量が増えると、その領域の神経活動が増えていることを示す。小脳/脳幹KOマウスの脳切片を作製し、cfos mRNAの量が調査された結果、小脳に存在するプルキンエ細胞でcfos mRNAが過剰に増えていることがわかった(画像6・7)。

|

|
|
マウスの脳内における神経活動の指標であるcfos mRNAの観察。小脳/脳幹だけでIP3R1を欠損させたマウス(小脳/脳幹KOマウス)のプルキンエ細胞(矢印の先)において正常マウスに見られないcfos mRNA量の増加が観察された。一方、大脳皮質や海馬のcfos mRNAに大きな違いは観察されなかった。画像6(左):正常マウス。画像7:小脳/脳幹KOマウス |
|
一方、てんかん発症に関連すると考えられている海馬や大脳皮質の領域では、正常マウスと比較してcfos mRNAの量に大きな違いはないことが判明。また、IP3R1欠損マウスと小脳/脳幹KOマウスの大脳皮質の神経活動を調べるために脳波を観察した結果、発作の発症時の脳波に異常は認められなかったという。そこで研究チームはこれらの結果とIP3R1欠損マウスに現れる捻転、硬直、後弓反張を踏まえ、「IP3R1欠損マウスに見られる症状はジストニアの病態と同じであり、ジストニアの発症メカニズムには小脳プルキンエ細胞の異常活動が関わるのではないか」という仮説を立てたのである。
研究チームは仮説を検証するために、小脳/脳幹KOマウスのプルキンエ細胞の神経活動に、どのような異常が生じているのかを調べることにした。具体的には、自由な行動をしている時の小脳/脳幹KOマウスのプルキンエ細胞の神経活動パターンを記録したのである。その結果、下オリーブ核から伸びる登上線維からのプルキンエ細胞への情報入力と思われる特徴的な神経活動パターンの増加が、ジストニアによる硬直と密接に関係することが発見された(画像1・2、8・9)。
次に研究チームは、プルキンエ細胞の異常活動が小脳/脳幹KOマウスのジストニアを発症させているかどうかを調査。プルキンエ細胞を持たない「Lurcherマウス」と交配させることで、プルキンエ細胞をなくした小脳/脳幹KOマウスを用いて検証が行われた。その結果、小脳/脳幹KOマウスのジストニアの症状が消失することが確認されたのである(画像10・11)。このことから、プルキンエ細胞がジストニア発症に深く関わることが明らかになったというわけだ。
さらにジストニア発症に下オリーブ核から登上線維を介したプルキンエ細胞への情報の入力異常が関係するかどうかが検証された。そのために、小脳/脳幹KOマウスの下オリーブ核に局所麻酔薬である「リドカイン」が投与され、その結果、ジストニアの症状が緩和されることが判明。一方、小脳/脳幹KOマウスの線条体におけるcFosタンパク質の発現や神経活動に明らかな異常は見つからず、また線条体へのリドカインの投与ではジストニアの症状は緩和されなかったのである(画像12~14)。
これらの結果から研究チームは、小脳と脳幹に発現するIP3R1を欠損させると、オリーブ核を介したプルキンエ細胞への情報の入力が異常になり、ジストニアを発症するという結論に至った(画像15)。これまで、大脳基底核の主要な構成要素である線条体を介した神経活動の異常が、ジストニア発症に関わると考えられてきたが、今回の成果により従来説とは異なる発症メカニズムが明らかとなったのである。
小脳・脳幹・脊髄を中心とする神経細胞が変性・脱落し、歩行障害などの強い運動障害を来す特定難病疾患として「脊髄小脳変性症(SCA15/16)」がある。その原因遺伝子として「IP3R1」が2004年に同定されるなど、これまでに多数が同定されているが、その分子病態は明らかにされておらず、現在、有効な治療法は知られていない。
そんなSCA15/16の患者は、これまで小脳失調だけを生じることが報告されてきたが、最近になってSCA15/16の患者に不随意運動が生じることも報告され始めている。今後、今回の研究を発展させることで、研究チームが明らかにしたIP3R1欠損マウスのジストニア発症とSCA15/16患者の不随意運動との関係が明らかにできるという。また、小脳/脳幹だけでIP3R1を欠損させると下オリーブ核から伸びる登上線維からプルキンエ細胞への情報入力がなぜ異常になるのか、その活性化メカニズムの解明が期待できるとしている。
小脳から出力された異常情報が大脳からの随意信号の情報とどのように交わった結果ジストニアの症状を起こすかということを明らかにしていくことが、新たなジストニアの治療法の確立につながると考えているとした。