科学技術振興機構(JST)と微生物化学研究会 微生物化学研究所(IMC)は4月22日、「カーボンナノチューブ(CNT)」を利用した再利用可能な高機能性「不斉触媒」を開発したと共同で発表した。
成果は、IMCの柴崎正勝署長らの研究チームによるもの。研究はJST課題達成型基礎研究の一環として行われ、詳細な内容は近日中に独国国際化学誌「Angewandte Chemie International Edition」オンライン速報版に掲載される予定だ。
糖、タンパク質、DNAなど、生命体を構成する物質は、同じ物質ながら右手物質の「D-体」、左手物質の「L-体」のどちらか片方のみで形成されている。D-体とL-体は、左手と右手のように構造としては同じながらもお互いがお互いの鏡像だ。そのため、平面上では重ね合わせることはできないことから「鏡像異性体(エナンチオマー)」の関係であり、こうした鏡像の構造を持つ分子を「キラル」という。
また、近年の化学用語でよく耳にする「キラリティー」は、この重ね合わせすことができない性質のことをという。医薬品を作る際は、このキラリティーは重要であり、L-体またはD-体の物質のみで合成しないと、医薬品になるどころか逆に体に大きな害を及ぼすことがあるのだ。
なお、通常の化学合成法を用いた場合は、D-体とL-体は等量ずつ生成されてしまう。しかし、前述したように作り分けが必要であり、それを可能とするのが「不斉触媒」だ。しかも、不斉触媒はただ作り分けられるというだけでなく、最も効率的な合成法を提供するものでもある。
そして現在、研究チームが研究開発を行っているのが、不斉触媒の1種である「協奏機能型不斉触媒」の創製と、それらを利用する医薬品の効率的合成法だ。協奏機能型不斉触媒は、生体内酵素のように複数の触媒機能を同時に発現させられることが最大の特徴で、さらに廃棄物を副生しないクリーンな化学反応を可能にする点も大きな魅力的ポイントだ。酵素と同様の化学反応促進機構であり、温和な反応条件下で反応促進を可能にすることから、環境に優しい合成化学を推進する上でカギとなる技術なのである。
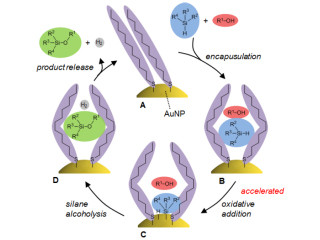
このユニークな触媒機能に、再利用性・高機能性の付加価値を追加することで実用性を兼ね備えた触媒の創製が実現するという。従来法による再利用を可能にする「固相(固体状態にある相)触媒化」は調製が難しく、触媒活性・立体選択性の大幅な低下をもたらすことが課題となっていた。そこで今回、新たな触媒固定化法を開発したことにより、触媒の固定化による再利用と高活性化を同時に実現させることに成功したというわけだ。
研究チームはこれまでに、医薬品合成などで使われる「anti-選択的触媒的不斉ニトロアルドール反応」を極めて円滑に進行させるNdとNaを含む協奏機能型不斉触媒を開発していた。この触媒は、前述した反応で世界最高性能の触媒能力を持ち、さらに「自己組織化」(複数の分子、金属イオンの混合物が自発的に会合を起こして規則的な高次構造を構築する現象)により不溶化して機能するという特徴も持つ。
しかし、この不溶性触媒の粒径は非常に微細かつ安定性も低いため、触媒の再利用が困難という課題があったのである。そこで今回、この触媒の自己組織化能に着目し、触媒の高活性化と再利用を同時に可能にする次世代型触媒の創出が試みられた次第だ。
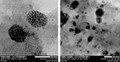
ナノスケールの微細網目構造を持つCNT溶液中に触媒を混ぜると、CNT壁面が触媒の自己組織化を誘起して、CNTが形成する網目状のネットワーク内で触媒成長が起きる。網目状の制限された空間であるため、自己組織化による触媒成長が数10~200nm程度の微粒子に抑えられると同時に、成長した触媒が網目ネットワーク内に封じ込められ、簡便に触媒の固相「担持」(触媒が何らかの物質に載っているような状態)ができることがわかった(画像1)。触媒が微粒子化したことにより、触媒の表面積が大幅に上昇して高活性化を実現し、要は簡便なろ過操作で再利用可能な不斉触媒として利用できるというわけだ。
このナノチューブ触媒を、「3,5-ジヨードベンズアルデヒド」とニトロ化合物「ニトロエタン」の「ニトロアルドール反応」(「ヘンリー反応」とも呼ばれ、塩基を媒介にして、ニトロ化合物、アルデヒドなどでβ-ニトロアルコールを得る反応)で用いた。
その結果、ナノチューブ触媒は従来型触媒と比較して1/6の触媒量でも円滑に反応を進行させ、反応生成物が98%収率で立体選択的に得られたのである(anti体/syn体=96/4、鏡像体過剰率95%ee)(画像2)。3,5-ジヨードベンズアルデヒドとニトロエタンの反応において、わずか0.5mol%のナノチューブ触媒により望みのニトロアルドール生成物が高い収率・立体選択性にて得られることが確認された。
さらに、触媒封じ込めにより簡便なろ過操作のみによる触媒の再利用も同時に実現され、6回の繰り返し使用実験でも高い触媒活性・立体選択性を維持した(収率83%、鏡像体過剰率98%ee)(画像3)。なお、ナノチューブ触媒は、簡便なろ過操作のみで繰り返し使用が可能で、高い触媒活性、立体選択性を維持する。3,5-ジヨードベンズアルデヒドとニトロエタンの反応において、ナノチューブ触媒と混合して振とうし、反応完結後は簡便なろ過操作・濃縮のみで生成物を単離することが可能だ。反応容器に残るナノチューブ触媒は繰り返し再利用することができる。
ちなみに鏡像体過剰率とは、D-体とL-体の鏡像体のどちらか一方が過剰に存在している場合にその程度のことをいい、「%ee(enantiomeric excess)」と表示する。例えば、右手型と左手型が95:5の比率で存在している場合、鏡像体過剰率は(95-5)/(95+5)x100=90%eeとなる。
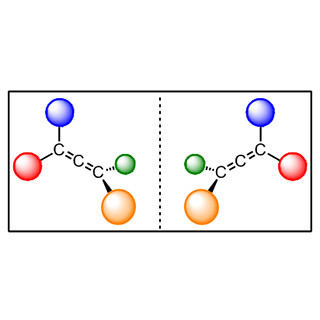
またanti体/syn体とは、2つの「不斉炭素」(分子のキラリティーを生じさせる原子を「キラル中心」といい、炭素が最も多い)を持つ化合物は、それぞれRとSの2種類の立体配置を採れることから、RR体、RS体、SR体、SS体という4つの異性体が存在する。それぞれ分子式や化学結合の様式は等しいが、立体的な分子のつながり方は異なるわけで、互いにRR体とSS体は鏡像異性体(エナンチオマー)だが、それ以外のRS体とRR体、SR体とSS体などを「ジアステレオマー」といい、RS体とRR体ならRS体をanti体、RR体をsyn体という。
ナノチューブ触媒はすでに利用されており、米国で臨床第3相試験中の高脂血症治療候補薬「アナセトラピブ」の不斉合成をすでに達成している(画像4)。ナノチューブ触媒により、医薬品合成に重要な炭素-炭素結合を形成できるため、現行法に比べて短工程での化学合成を実現しているという。実際にアナセトラピブでは、ニトロアルドール生成物から4工程で光学的に純粋なアナセトラピブを合成可能だ。従来法では、「アラニン」をキラル原料として6工程で合成されており、2工程分少ないというわけである。
anti-選択的触媒的不斉ニトロアルドール反応は、多くの医薬品が共有する「1,2-アミノアルコール」部位を高い立体選択性で構築できる有用な炭素-炭素結合形成反応だ。今回新たに開発されたナノチューブ触媒は、この高付加価値な化学反応を促進する高活性・再利用可能触媒として機能する点が大きな魅力だ。研究チームが2011年に合成を達成した抗インフルエンザ薬「リレンザ」も1,2-アミノアルコール部位を持っており、そうしたことから、多くの医薬品の安価・大量合成を可能にする基盤科学技術となることが期待されるとしている。