東北大学大学院医学系研究科、同大学医学系グローバルCOE、東京都福祉保健局、東京都医学総合研究所の4者は8月3日、活性酸素種や毒物などのセンサである「Keap1」が、細胞の自食機構「オートファジー」により分解されていることを発見したと発表した。
成果は、東北大大学院 医学系研究科 医化学分野の山本雅之教授、東京都医学総合研究所の小松雅明副参事研究員らの研究グループによるもの。研究の詳細な内容は、米国学術誌「Proceedings of the National Academy of Sciences of the United States of America(PNAS)」に掲載の予定だ。
オートファジーは、細胞が飢餓状態に陥った時に自分で自分の一部を食べてしまう現象として、1960年代に肝細胞の観察から発見された。しかし、関連する機能因子が不明であったため、その詳細は長い間不明だったという経緯がある。
その後、出芽酵母の解析からオートファジー関連遺伝子群が次々に発見され、最近では「プロテアソーム」系と並ぶ重要なタンパク質分解機構であると認識され、メカニズムの解析が急速に進んでいるところだ。
なおオートファジーは従来、飢餓状態に陥った細胞が細胞内小器官やタンパク質を無差別に飲み込んで分解するものと理解されていた。しかし最近では、選ばれたタンパク質や細胞小器官だけが分解されるという選択的オートファジーの存在が明らかになってきた。
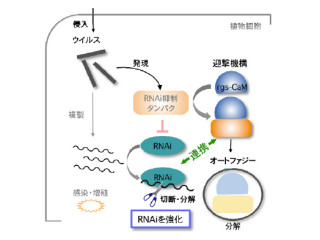
また、「Keap1-Nrf2」制御システム(画像1)は、生体のストレス応答機構の中心的役割を果たしている。転写因子「Nrf2」はさまざまな生体防御系遺伝子群の発現を活性化して、細胞のストレス応答能を増強する役割を担う。
一方、Keap1はプロテアソーム系によるNrf2分解を促進し、Nrf2の機能を抑制するという機能を持ち、細胞に活性酸素種や毒物などのストレスが加わると、Nrf2の分解が停止する仕組みだ。
これによりNrf2が機能できるようになり、細胞のストレスに対する抵抗性が高まる。このように、Nrf2の機能がタンパク質分解機構と連関して制御されていることが知られていた。それに対して、Keap1機能の制御に何らかのタンパク質分解メカニズムが関与しているのかどうかは不明だった。
今回の研究グループは、オートファジー全体が障害されている「Atg7」遺伝子の欠失マウスや選択的オートファジーに必要な「p62タンパク質」を欠失したマウスを解析することにより、Keap1がオートファジーにより選択的に分解されることを解明した(画像2)。

|
|
画像2。オートファジー機能不全によるKeap1及びp62の蓄積。「オートファゴソーム形成」に必須のAtg7遺伝子の欠失によりオートファジーの機能を破綻させたマウスにおいては、p62と同様にKeap1がタンパク質レベルで蓄積した |
この成果は、ストレス応答を担うセンサ分子Keap1と転写因子Nrf2が、それぞれ異なる経路により分解されていることを示すものであり、多様なタンパク質分解経路により生体のストレス応答が精巧に制御されていることを実証する重要な発見であると、研究グループはコメントしている。