理化学研究所(理研)は6月27日、組織の発生や分化に重要な役割を担うT-box転写調節因子「Tbr2」が、嗅覚情報の興奮-抑制バランスを調節する機能を持ち、正確な嗅覚情報の伝達に重要な役割を果たしていることを、マウスを用いた実験で突き止めたと発表した。
成果は、理研 脳科学総合研究センター シナプス分子機構研究チームの水口留美子研究員、吉原良浩チームリーダーらの研究グループによるもの。研究の詳細な内容は、日本時間6月27日付けで米科学雑誌「The Journal of Neuroscience」に掲載された。
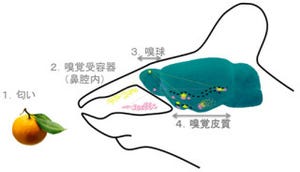
嗅覚は、動物の摂食行動、繁殖行動、社会行動など、さまざまな生命活動に不可欠だ。匂い分子は、鼻腔内部を覆う粘膜(嗅上皮)に存在する嗅細胞で受容され、そのシグナルは嗅細胞の軸索を介して嗅覚の一次中枢である嗅球に伝えられる。嗅球の出力ニューロン(僧帽細胞など)は、嗅細胞から匂いの情報を受け取り、それを脳の高次嗅覚中枢(嗅皮質など)に伝達する仕組みだ(画像1)。
嗅球には、出力ニューロンのほかにも種々の抑制性・興奮性の介在ニューロンがあり、局所的な神経回路を形成して出力ニューロンの活動を制御している。嗅球内での出力ニューロンや介在ニューロンは、匂い情報の興奮-抑制バランスを調節し、匂いを検出する感受性の制御や、匂いの正しい識別に重要な役割を担う。
画像1は、マウスの嗅覚系のモデル図。匂い分子は、嗅上皮に存在する嗅細胞によって受容され、その情報は嗅細胞の軸索を介して脳の嗅球に伝えられる。出力ニューロンは、嗅球の表面に存在する糸球体に主樹状突起を伸ばし、嗅細胞からの情報を受容する仕組みだ。
そして出力ニューロンに伝えられた匂い情報は、嗅球内で処理された後、嗅皮質などの高次嗅覚中枢に伝えられ、匂いの認識や記憶、情動の変化などを引き起こす。
嗅球内で機能的な神経回路が形成されるには、出力ニューロンと介在ニューロンがお互いを正しく認識し、シナプスを形成してネットワークを構築することが必要だ。しかしこれまで、嗅球内の局所的神経回路形成を制御する分子メカニズムは、ほとんど明らかにされていなかったのである。
研究チームは、Tbr2遺伝子を欠損させたマウスを作製し、Tbr2が嗅球内神経回路形成と匂い情報の処理にどのような役割を果たすかの解析を試みた。しかし、Tbr2遺伝子は個体発生初期に重要な働きをするため、全身で欠損させるとマウスは胎生致死となってしまう。
そこで、研究チームはコンディショナル遺伝子欠損法を用いて、嗅球の出力ニューロンだけでTbr2遺伝子を欠損するマウスが作製された。このマウスは成体になるまで生存可能で、嗅球の形態にも大きな異常は観察されなかったのである。
しかし、出力ニューロンを調べると、さまざまな遺伝子発現の変化が起こっていた。例えば、Tbr2と同じT-box転写調節因子ファミリーに属するTbr1の発現が上昇していたのである。また、シナプス前部での神経伝達物質の取り込みや貯蔵を行うタンパク質のタイプが変化していた。
さらに、Tbr2遺伝子欠損マウスの出力ニューロンは、樹状突起の形態にも異常を示したのである。野生型マウスでは、出力ニューロンの主樹状突起は「糸球体」に向かって真っすぐ垂直に伸びるが、Tbr2遺伝子欠損マウスでは折れ曲がり、ランダムな方向に伸びたのだ。
また、主樹状突起から枝分かれする副樹状突起の形態にも違いがあった。野生型マウスの副樹状突起は僧帽細胞層に対して平行に伸びるが、Tbr2遺伝子欠損マウスではばらばらな方向に枝分かれしていた(画像2・3)。これらの結果から、Tbr2は出力ニューロンの正常な分子発現と形態形成に重要な役割を持つことがわかったのである。
|
|
|
|
野生型マウスとTbr2遺伝子欠損マウスの出力ニューロン(僧帽細胞)の樹状突起の形態。画像2(左)は野生型マウスのもので、主樹状突起(青矢印)が糸球体に向かって真っすぐに伸び、副樹状突起は僧帽細胞層に対して平行に伸びる。画像3はTbr2遺伝子欠損マウスのもの。主樹状突起がランダムな方向に伸長し、副樹状突起はさまざまな方向に枝分かれする |
|
出力ニューロンは、嗅球内で種々の介在ニューロンと樹状突起間シナプスを形成し、抑制性、興奮性の入力を受けている(画像4・左)。Tbr2遺伝子欠損マウスの出力ニューロンは、樹状突起に形態異常を示すことから、介在ニューロンとのシナプス形成にも異常が生じているのではないかと予測した。
画像4は、Tbr2遺伝子欠損による嗅球内神経回路の異常。Tbr2遺伝子欠損マウスの嗅球では、出力ニューロンの遺伝子発現と共に樹状突起の形態が変化する。同時にさまざまな介在ニューロンの発達にも異常が生じ、出力ニューロンと正しくシナプス結合できなくなってしまう。その結果、出力ニューロンへの抑制性シグナルが減少し、出力ニューロンが過剰に活性化するというわけだ。
まず研究チームは、嗅球内のさまざまな介在ニューロンの数や形態について調べた。すると、抑制性の介在ニューロンの一種である「パルブアルブミン陽性介在ニューロン」の数が半分以下に減少しており、それらの樹状突起は発達不全だった(画像5・6)。
|
|
|
|
野生型マウス(画像5(左))とTbr2遺伝子欠損マウス(画像6)の介在ニューロンの分化。Tbr2遺伝子欠損マウスでは、嗅球のパルブアルブミン陽性介在ニューロン(赤)の数が減少する。また、細胞体の大きさが小さく、樹状突起も発達不全である |
|
また、一部の「顆粒細胞」や「傍糸球体細胞」の樹状突起の分化にも異常が生じていることがわかった。これらのことから、Tbr2は出力ニューロンの分化だけでなく、周囲に存在する介在ニューロンの発達や分化にも影響を及ぼしていることが明らかになった(画像4・右)。
次に研究チームは、シナプスに局在する分子群を指標として、出力ニューロンと抑制性介在ニューロンの樹状突起間シナプスの数が調べられた。その結果、Tbr2遺伝子欠損マウスでは、野生型マウスに比べて出力ニューロンの樹状突起が受ける抑制性シナプスの数が約半分に減少していた。
このことからTbr2は、嗅球内で出力ニューロンと抑制性介在ニューロンからなる局所的な神経回路の形成に、重要な役割を果たしていることが明らかとなった。Tbr2遺伝子欠損マウスは、嗅球内での匂い情報の処理がうまくできないため、匂いを感じる機能にも異常をきたしている可能性が考えられた。
そこで研究チームは、Tbr2遺伝子欠損マウスにさまざまな種類の匂いを嗅がせ、転写調節因子「NFkB」のリン酸化を指標として、嗅球内で活性化されるニューロンの数を野生型マウスと比較した。その結果、Tbr2遺伝子欠損マウスでは、同じ匂いを嗅がせた野生型マウスに比べて、活性化される出力ニューロンの数が約2倍に増えていたのである(画像7)。
画像7は、匂いに対する出力ニューロンの過剰な活性化。野生型マウス(青)とTbr2遺伝子欠損マウス(赤)に、さまざまな匂い(酢酸イソアミル、オイゲノール、オクタナール)を嗅がせ、活性化した出力ニューロン(僧帽細胞)の数を定量化した。Tbr2遺伝子欠損マウスでは、すべての匂いに対して約2倍の数の出力ニューロンが活性化している。
一方、匂いにより活性化される傍糸球体細胞の数は約6割程度に減少した。以上のことから、Tbr2遺伝子欠損マウスでは、出力ニューロンと介在ニューロンの樹状突起間シナプスが形成できなくなることで、活性化した介在ニューロンの数が減少し、その結果、本来出力ニューロンが受けるはずの抑制性のシグナルが低下して、出力ニューロンの活性が上昇し、匂い刺激に対して過剰に反応していると考えられた。
つまり、Tbr2は嗅球内の局所的な神経回路形成を正しく形成・維持することによって、匂い情報の興奮-抑制バランスを調節していると考えられる。
嗅球内の神経回路は、外界からの匂い情報を適切に処理して高次嗅覚中枢に伝えることにより、匂いに対する感受性の調節や匂いの識別などに重要な役割を果たす。
また、嗅球の介在ニューロンは成体でも常に産生され、新しく神経回路に取り込まれて、嗅覚機能の恒常性維持や可塑的変化にも機能すると考えられている。従って、嗅球ニューロンの分化や神経形成回路の形成に重要な役割を果たすTbr2遺伝子の異常は、嗅覚機能の障害の原因にもなると考えられるという。
Tbr2遺伝子欠損マウスは、嗅覚障害の病態メカニズムを研究する手がかりになるだけでなく、動物の匂いに基づいた行動の分子基盤を解明する上でも、非常に興味深いモデル動物になると期待できると、研究グループはコメントしている。