京都大学は1月23日、英オックスフォード大学と共同で、約100nmのDNA平面構造上に作成した経路で、DNAで作成した分子モーターの進行をナノスケールの精度で人為的にコントロールする技術を開発したと発表した。京都大学物質-細胞統合システム拠点(iCeMS)・理学研究科の杉山弘教授、iCeMSの遠藤政幸准教授らの研究グループによるもので、成果は英科学誌「Nature Technology」オンライン版で、日本時間1月23日に掲載された。
分子の大きさの世界であるナノスケールで、分子を思った通りに並べて動かす技術は、化学分野だけでなく、生物や物理など科学全般に重要なテーマとなってきている。
分子は生物を構成する最小単位であり、その分子が遺伝情報などのプログラムに従って規則的に集合し、組織化されることで高度に機能する生物に組みあがっているのは説明するまでもない。こうした、規則に従って分子が集合する現象である自己集合を人為的に行うためには、あらかじめ分子に指令(プログラム)を書いておき、その指令に従って集合させる必要がある。
DNAは4つの塩基がテープ状に配列された分子であり、塩基配列というプログラムに従って、2重らせんの形成を行う。研究グループは、DNAの配列を設計することでさまざまな構造体を作成し、その上にさらに分子を思った通りに並べる技術を開発中だ。
この技術は「DNAオリガミ法」と呼ばれており、DNAから自己集合によってナノ構造体を作成する技術である(画像1)。この技術を使えば、1つひとつの分子を作成した構造上の好きな場所にナノメートル単位で正確に置くことが可能だ(画像1・右)。

|
|
画像1。DNAオリガミ法を用いたナノスケールの構造体の作成方法。短い相補鎖DNAに目的とする分子(緑丸)を結合しておけば、DNAオリガミ構造体上の好きな位置に分子を配置できる。分子を配列したDNA構造体のAFM画像 |
分子を見る装置は原子間力顕微鏡(AFM)で、数nmの大きさの分子を見分けることができる。研究グループでは、分子モーターが動く様子をAFMで直接観察する方法も開発してきたほか、これを応用して、複雑な経路をDNAオリガミ上に作成し、あらかじめ組み込んだプログラムに従って、DNAモーターの進行方向をナノスケールでコントロールできる手法を開発し、この動きをAFMで捉えることに挑戦した次第だ。
ナノスケールの世界で機械的な動きを再現できる分子機械として、現在は反復運動や回転運動、移動などさまざまな運動ができるものが開発されてきている。今回の研究で用いたのは、DNAを使って作成した「DNA分子モーター」と呼ばれるもので、1方向へ移動していく機能を持つ(画像2)。
この中で、1列に並んだ1本鎖DNA(図2・緑色のDNA)に対してそのDNAモーターの相補鎖DNA(画像2・赤色のDNA)が結合し、2本鎖DNAとなると、この塩基配列で酵素が切断し、1本鎖DNAが短くなる。これによって、DNAモーターはより安定に結合できる隣の長い1本鎖DNAへ移動していく。この反応が繰り返されれば、DNAモーターは1列に並べた1本鎖DNAに沿って順次移動していくことになるというわけだ。
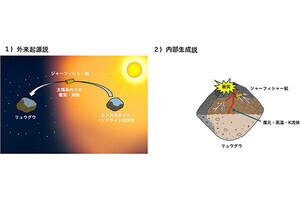
次に、このDNAモーターが動くためのレールとなる部分を作る必要がある。これには数nmの精密さで分子を決められた場所に並べる技術が必要だ。ここではDNAオリガミを使って平面構造を作り、その上に設計した通りのDNAモーターが動く1本鎖DNAからなる経路(レール)を作成(図3)。今回の研究では、経路が複数分岐したところを作り、指令に従って、DNAモーターの進行方向がコントロールできるかが試みられた。
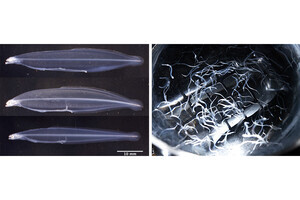
DNAオリガミ法で作成した長方形の構造体の上に、1本鎖のDNAを等間隔に並べ、3つの分岐点がある経路を作成(図3および図4・上)。AFM画像では作成した経路の形をその通りに見ることが可能だ(図4・下)。

|

|
|
画像3。DNAオリガミ構造上への1本鎖DNAによる経路(レール)の導入。経路には3つ分岐点とその両側にゲート(LまたはR)が作られている。終着点は4箇所。画像は酵素反応前の初期構造 |
画像4。上がDNA構造体に作成した1本鎖DNAからなる経路で、下がそのAFM画像 |
この経路のスタートの位置にDNAモーターを配置。酵素反応により、DNAモーターはこの位置から順次隣のDNA鎖に移動していき、最初の分岐点でDNAモーターは右か左かのどちらかに移動する。ここに、DNAモーターの進行を妨げる分子を導入しておけば、そちらの方向へは進めなくなる仕組みだ。つまり、ゲートの役割を果たすことができるのである。ゲートの仕組みは図5のようになり、あらかじめ両側のゲートに2本鎖を形成させておけば、DNAモーターはどちらにも通過することができなくなるというわけだ。
このゲートの片側を開く、つまりゲートを形成している2本鎖から相補鎖を引き抜けば、そちらを通過できることになる。これにはゲートの相補鎖に余分な配列をつけておき、それと完全に相補的なDNAを加えて結合させれば、引き抜くことが可能だ。そうすれば開いた方は1本鎖となり、そちらにDNAモーターが進行できるようになる(画像5)。このように、あらかじめ設計した配列のDNAでゲートを開くことができ進行方向をコントロールできるというわけだ。
ここでは、3つの分岐点の左右両側にゲートを設け、DNAモーターは2つの分岐点を通過して、最終的に4つの終着点までたどり着き、そこで停止。1番目と2番目の分岐点でゲートを両方とも左に開いておけば、DNAモーターは最も左の終着点(L、L)の位置に到達する。同様に1番目の右のゲートと3番目の左のゲートを開いておけば、終着点(R、L)の位置にDNAモーターを誘導可能だ(図4・上)。
このDNAモーターの動きをAFMで時間を追って観察したのが、画像6である。DNAモーターには分子の「ビオチン」が結合してあり、酵素反応後にタンパク質「ストレプトアビジン」をビオチンに結合することで、DNAモーターの位置をAFMによって観察した。
DNAモーターが最終的に到達した位置を調べると、ゲートの開いた方向へDNAモーターが進行していくことを確認。つまり、分岐点でのゲートの開閉によって、DNAモーター分子の進行をコントロールでき、最終地点への誘導が可能であることが確かめられたというわけだ。また、水溶液中でもこのDNAモーターの進行方向のコントロールを確認している。
また、DNAオリガミ上の終着点に異なる蛍光基をあらかじめ配置しておき、DNAモーターに消光基(接近したときに蛍光が出ないようにする分子)を結合し、同じようにゲート操作とDNAモーターの進行を行うと、ゲートの開いている経路の最終地点の蛍光だけが弱くなる(消光される)ことが判明(画像6)。つまり、この系はAFM測定のような表面に固定した1分子観察だけでなく、水溶液中でも同様に進行することが確認できたのである。