金沢大学(金大)と九州大学(九大)は2月3日、自閉症の原因タンパク質である「CHD8」が、造血幹細胞の機能維持に重要な役割を果たすことを明らかにしたと共同で発表した。
同成果は、金大 医薬保健研究域医学系の西山正章教授、九大 生体防御医学研究所の中山敬一主幹教授、同・仁田暁大研究員らの共同研究チームによるもの。詳細は、米科学雑誌「Cell Reports」に掲載された。
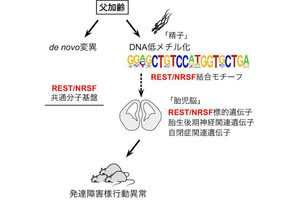
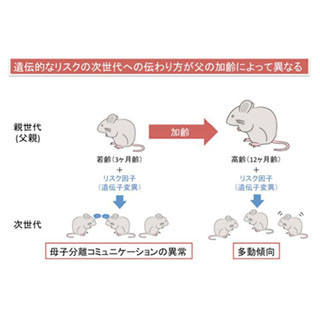
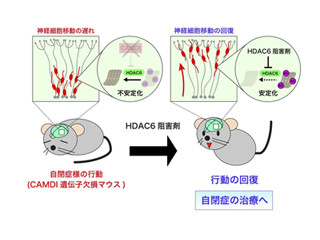
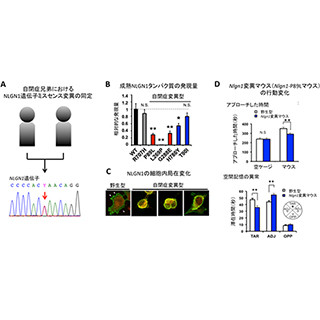
自閉症は有病率1%を越える頻度の高い神経発達障害で、胎生期の神経発生の異常により発症する脳の疾患として知られる。近年の自閉症患者に関する遺伝子変異解析により、タンパク質の「Chromodomain Helicase DNA binding protein 8(CHD8)」がもっとも変異率の高い遺伝子であることが判明。CHD8は「クロマチンリモデリング因子」と呼ばれ、染色体(クロマチン)構造を変化させる(リモデリング)機能を持ち、遺伝子の発現量を調節する役割を担っている。
-

CHD8によるクロマチンリモデリングの模式図。染色体(クロマチン)は、DNAがヒストンというタンパク質に巻き付いたヌクレオソームという構造を採ることで、高度に折り畳まれて核の中に収納されている。遺伝子が発現する際には、この染色体が弛緩したり凝縮したりすることで制御されている。CHD8はこの染色体の構造を変化させるクロマチンリモデリング活性を有しており、遺伝子の転写のON/OFFを制御している (出所:九大プレスリリースPDF)
CHD8については多くの研究がこれまでなされているが、自閉症の原因遺伝子であることからそのほとんどが神経系に特化したものとなっている。しかしCHD8の発現は、神経系以外でも高いことが特徴として知られている。特に胚性幹細胞や組織幹細胞など、未成熟な細胞で高発現していることが確認されている。しかし、非神経系の組織幹細胞でのCHD8の機能は、そのほとんどが未解明のままだった。
そこで共同研究チームは今回、非神経系の組織幹細胞におけるCHD8の機能を評価するため、組織幹細胞研究でも多くの知見がある造血幹細胞の機能評価に着手することにしたという。
造血幹細胞とは、成人では骨髄中に存在する組織幹細胞の一種だ。すべての血液細胞に分化する能力を持つのが特徴である。造血細胞から各種血液細胞に至るまではいくつかの分化段階がある。そのため、今回の研究においては、まず野生型のマウスの造血幹細胞と造血幹細胞から分化した細胞を対象に、各分化段階におけるCHD8の発現量の比較が行われた。その結果、造血幹細胞においてCHD8が最も発現していることが明らかとなったという。
次に、血液細胞において特異的にCHD8を欠損するマウスが作製され、解析が行われた。その結果、CHD8を欠損した造血幹細胞が異常に増加しており、造血幹細胞から分化した細胞が顕著に減少していることが判明。さらに、末梢の血液細胞が有意に減少していることから、汎血球減少を引き起こしていることも確認された。また増加した造血幹細胞は、その機能を消失していることも明らかとなったのである。
-

(左)造血幹細胞は骨髄中にごく少数存在しており、正常なマウスの造血幹細胞の量は全骨髄細胞のうちの0.01%だが、CHD8を欠損することでその割合は0.3%以上と顕著に増加する。(右)一方で、この増加した造血幹細胞は機能を失っているため、コントロールで認められるコロニーが形成されない。CHD8が欠損することにより、造血幹細胞の機能が障害される (出所:九大プレスリリースPDF)
続いて、CHD8欠損により造血幹細胞からの血液細胞の供給ができない原因を分析するため、CHD8欠損造血幹細胞に対し、RNAシークエンスを用いて網羅的に遺伝子発現状態の評価が実施された。すると、がん抑制遺伝子「p53」の下流遺伝子に関して、その発現における顕著な上昇が認められたのである。この結果は、定常状態でCHD8がp53活性を抑制していることが考えられるという。
-

CHD8はp53遺伝子と結合することで、p53下流遺伝子の発現を抑制している。したがって、CHD8を欠損するとp53が活性化し、p53下流遺伝子の発現が上昇。RNAシークエンス解析から、CHD8を欠損した造血幹細胞ではp53下流遺伝子の発現が顕著に増加していることが明らかとなった。CHD8欠損造血幹細胞では、がん抑制遺伝子p53の下流遺伝子の発現が上昇するのである (出所:九大プレスリリースPDF)
さらに、p53は細胞増殖や細胞死に深く関与していることから、CHD8欠損造血幹細胞の細胞周期およびアポトーシスの評価も実施された。その結果、CHD8欠損造血幹細胞は細胞周期が停止していることが判明。さらに、これらの細胞周期が停止した造血幹細胞が、アポトーシス(プログラムされた細胞死)を引き起こしていることも明らかとなったのである。
以上のことから、CHD8を欠損した造血幹細胞は、p53活性が上昇することで造血幹細胞からの分化に障害を来し、下流の血液細胞が産生できなくなることと、自己複製能を消失した後、アポトーシスを引き起こしていることの2点が示唆された。
最後に、CHD8欠損による造血幹細胞の機能の消失が、p53の活性によるものなのかどうかを評価するため、血液細胞特異的にCHD8欠損するマウスに、追加でp53遺伝子を欠損するマウスが作製された。その結果、CHD8を欠損した造血幹細胞で示唆された上述した2点に関して、部分的に回復することが明らかとなった。
-

(上)CHD8とp53の両方を欠損させると、CHD8欠損で認められた造血幹細胞の増加が顕著に減ることが確認された。(下)CHD8の欠損により失った造血幹細胞としての機能が、p53を追加で欠損させることにより回復したため、コロニーを形成する能力がコントロールと同程度となった (出所:九大プレスリリースPDF)
以上の結果より、造血幹細胞においてCHD8を欠損すると、がん抑制因子のp53が活性化し、造血幹細胞の多分化能や自己複製能に障害を来すことが明らかとなった。このことは、CHD8遺伝子に変異を持つ自閉症患者の治療を目指す際の重要な知見となるとしている。
また今回の研究成果により、CHD8は神経系のみならず、造血幹細胞でも重要な機能を果たしていることが判明したとする。自閉症は胎生期の神経発生の異常により発症すると考えられているが、CHD8は出生後でも重要な機能を担っていることが確認された。今回の研究成果が、今後のCHD8をターゲットとした治療薬を開発する際の一助となることが期待されるという。