京都大学は、「免疫グロブリン」の組み換えと「体細胞変異」に必須の分子「Activation-induced cytidine deaminase(AID)」が、その「C末端」部分によりDNAのシナプスを形成する機構を明らかにしたと発表した。
成果は、京大 医学研究科の本庶佑 客員教授、同・大学院生のSomayeh Sabouri氏、同・小林牧 特定准教授らの研究チームによるもの。研究の詳細な内容は、1月27日付けで米科学雑誌「米科学アカデミー紀要(PNAS)」電子版に掲載された。
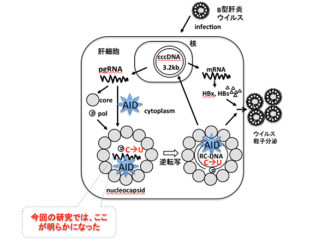
AIDは、DNAの1本鎖を切断することにより、免疫グロブリン(Ig)遺伝子のクラススイッチ組み換え、相同組み換え過程「ジーンコンバージョン(GC)」および「体細胞突然変異」を開始する。クラススイッチ組み換えの過程では、AIDがドナーおよび「アクセプター」となる各々のスイッチ(S)領域にDNAの1本鎖切断を形成し、DNA損傷修復機構がほとんど突出配列のない2本鎖切断に処理する。その結果生じたDSB断片は、互いに引き寄せられ(synapse形成)、結合されるという仕組みだ。
AID-C末端の変異体細胞では、DNAの1本鎖切断と体細胞突然変異を起こす効率は野生型細胞と同程度であるが、クラススイッチ組み換えの効率が著しく低下してしまう。これは、AID-C末端部分がDNAの1本鎖切断後の2本鎖切断の形成に必要である可能性を示している。この仮説を検証するために、修復結合とsynapse形成におけるAID-C末端部分の機能が検討され
まず、AID-C末端変異体によるクラススイッチ組み換えの効率は非常に低いが、そのクラススイッチ組み換えにより構成された結合部の配列が解析されたところ、結合部に0~3塩基対の短い相同配列を持つクローンが減少し、逆に4塩基対以上の相同配列を持つものが増加することが確認された。これは、「古典的非相同性結合古典的非相同性結合」が損なわれ、代償的にAlternative end joiningが働くことが示唆されたという。
そこで「クロマチン免疫沈降法」が用いられ、古典的非相同性結合に関わる分子のS領域への集積を解析したところ、AID-C末端変異体細胞ではKu80やXRCC4などの古典的非相同性結合に関わる分子のS領域への集積が、野生型細胞と比べ低下していることがわかった。
一方、DNAの1本鎖切断に特異的に結合する「PARP1」の集積は野生型よりも高かったため、AID-C末端変異体ではDNAの1本鎖切断からDNAの2本鎖切断へと処理する過程が障害されていると考えられたという。さらに、synapse形成に重要な「53BP1」、「DNA PKcs」や「UNG」などのS領域への集積も減少し、DNAの2本鎖切断形成の不良によりsynapse形成が低下している可能性が考えられたのである。
実際に、100万塩基対離れた染色体領域同士の相互作用を検出する「Chromosome Conformation Capture(3C)法」では、AID-C末端変異体細胞でのドナー・アクセプター間のsynapse形成低下が示された。次に「DT40細胞」を用い、AIDによるDNAの1本鎖切断を起点とするGCについての検討がなされた。
この細胞では、「Ig遺伝子可変(V)領域」において、上流の偽V領域との間でGCを起こす。なお、AID-C末端変異体はGCの効率も野生型と比較し低下していることが確認されている。これはDNAの1本鎖切断よりDNAの2本鎖切断の方がGCに有利なためと推測され、AID-C末端変異体のDNAの1本鎖切断からDNAの2本鎖切断形成への処理効率の低下を反映する結果と考えられるとした。
以上の結果を総合すると、AID-C末端部分はクラススイッチ組み換えとGCの双方において、DNAの1本鎖切断からの2本鎖切断の形成とsynapse形成に必要であることが示唆された形だ。今回の研究では、AIDがDNAの1本鎖切断に加え、そのC末端部分を介し、1本鎖切断に続く2本鎖切断端の形成とsynapse形成において必須の機能を担うことが明らかとなったというわけである。