東京大学(東大)は、これまで主に細胞質(細胞核以外の部分)で起こると考えられていたmicro-RNA(miRNA)によるRNAサイレンシングにおいて、miRNAが細胞核に輸送される分子機構を解明したことを発表した。
同成果は同大大学院理学系研究科 生物化学専攻の西賢二 特任教授、同 程久美子 准教授らによるもので、詳細は米国RNA学会誌「RNA」オンライン版に掲載された。 近年、ヒトを含む多くの生物種にて、miRNAやsmall interfering RNA(siRNA)といった長さ20数塩基の小さなRNAが、転写後の段階で遺伝子の発現を抑制する「RNAサイレンシング」と呼ばれる仕組みが存在することが明らかになってきた。
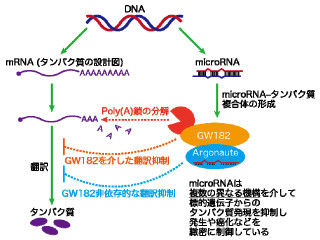
miRNAは、直接相互作用するAgoタンパク質やAgo結合タンパク質であるGW182などとRNA-induced silencing complex(RISC)と呼ばれる複合体を形成し、相補的な塩基配列をもつmRNAと対合して、その分解や翻訳抑制を引き起こすことが知られており、miRNAによって抑制されるmRNAは主に成熟型のmRNAであることや、AgoやGW182が細胞質内の顆粒状構造体であるProcessing body(P body)に局在することなどから、RNAサイレンシングは細胞質で起こる現象だと考えられてきた。しかし、核内にもmiRNAやAgoが存在することや、小さなRNAが、核内で転写レベルで遺伝子発現を制御したり、mRNAのスプライシングを制御することを示唆する結果も報告がされていたものの、こうしたmiRNAやAgoを含む複合体が、どのような仕組みで核内に運ばれて機能するのかという分子的な機構については不明のままであった。
そこで研究グループはmiRNAの核内移行の分子機構を明らかにする目的で、まずmiRNAと相互作用するタンパク質の細胞内局在解析を実施した。特にヒトGW182ファミリータンパク質の1つであるTNRC6Aに着目し、そのさまざまな領域の断片に緑色蛍光タンパク質(GFP)を融合させたタンパク質をヒト培養細胞に発現させて局在を解析したところ、TNRC6Aの一次配列には核移行シグナルと核外移行シグナルの両方が存在することが判明した。
そこで、同定した核外移行シグナルが本当に機能するか調べる目的で、核外移行シグナルのアミノ酸配列に変異を導入したところ、ほとんどのTNRC6Aは核内に留まり、きれいな点状の局在を示すことが確認されたという。
また、核外移行シグナルに加えて核移行シグナルにも変異を導入したところ、こうした核移行は見られず、大部分は細胞質に局在することが確認された。この結果、TNRC6Aは、今回見出された核移行シグナルと核外移行シグナルの両方の働きにより、核と細胞質の間を行き来する核-細胞質間輸送タンパク質であることが明らかとなったのである。
さらに、TNRC6Aの核外移行シグナル変異体が存在する核内の点状構造体には、Agoタンパク質やmiRNAも共局在していることも確認されたという。
このようなAgoタンパク質やmiRNAとの共局在は、Ago結合領域を欠いたTNRC6Aでは見られなかったことから、TNRC6AはAgoとの相互作用を介してmiRNAを核内に輸送していると考えられるほか、TNRC6Aの核外移行シグナル変異体を強制発現させると、非翻訳性核RNAとして知られているMALAT-1に対するsiRNAによるノックダウン効果が増強されることも確認され、これらによりTNRC6Aが核内におけるRNAサイレンシングに関わっていることが考えられるという結論に至ったという。
研究グループでは、核内miRNA複合体は、核内RNAを発現抑制する他にも、転写段階での遺伝子発現制御やRNAのスプライシングを制御する可能性、さらにはまったく未知の機能をもつ可能性も考えられるとしており、今後は、miRNA-Ago-TNRC6Aを最少単位とする核内複合体の機能を明らかにするために、この複合体に含まれる他のタンパク質分子や標的とするRNAの同定を目指すとしている。