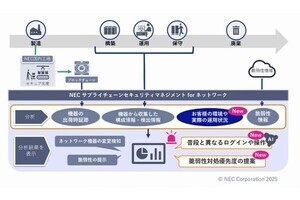
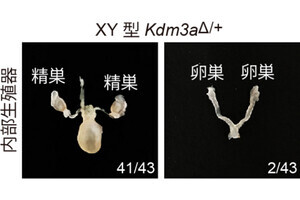
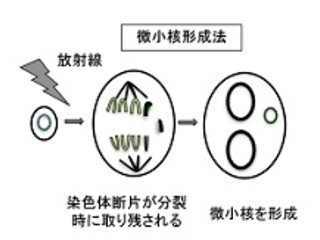
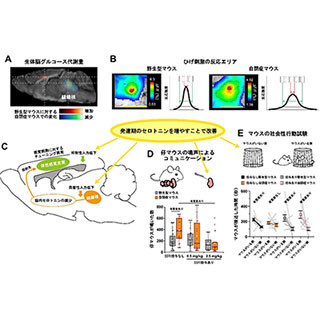
産業技術総合研究所(産総研)は、同所バイオメディカル研究部門 細胞・生体医工学研究グループの髙田英昭 主任研究員らの研究グループが、カルシウムイオンが欠乏すると染色体の動原体の構成因子であるCENP-Fタンパク質が動原体から消失することで動原体微小管が不安定化し、その結果染色体の整列が異常になることを明らかにしたことを発表した。
この成果は8月4日、英国のオンライン科学雑誌「Scientific Reports」に掲載された
生物の遺伝情報はDNAに記録されており、細胞が分裂するときにはDNAが染色体と呼ばれる構造に折り畳まれることで、ふたつの娘細胞に、複製されたDNAが安全・均等に分配される。ところが、どのように生物が染色体の構造を構築するのかは明らかになっていない。染色体の構築メカニズムが解明できれば、染色体数の異常や細胞のがん化など、疾患の治療・予防につながる手掛かりが得られると期待されている。
近年、DNAとタンパク質の集合体であるクロマチン構造と遺伝子発現の関係が注目されており、胚発生や細胞分化の過程でのクロマチンの構造変化の報告が増加している。また、細胞分裂時のクロマチン構造の異常はゲノムの不安定化につながり、重篤な疾患の原因となる。
産総研は、こうした背景から、細胞分裂期のクロマチン構造の変化(染色体構築)に着目し、カルシウムイオンが及ぼす影響を調べた。
細胞内カルシウムイオン濃度の減少により生じる染色体整列異常の原因を解明するために、まずは分裂期染色体の動態に重要な微小管の安定性を評価した。プロテアソーム阻害剤(MG132)でヒト培養細胞(HeLa細胞)を分裂中期の状態で停止させ、その細胞をBAPTAとイオノマイシンで処理して細胞内のカルシウムイオンを減少させた。この細胞を低温にさらすと、染色体の動原体に結合していない不安定な微小管が脱重合する。カルシウムイオンが減少した細胞では大部分の微小管が消失し、通常の細胞に比べて動原体に結合した微小管(動原体微小管)の安定性が低下することが分かった。
次に、動原体の形成に必要なタンパク質の局在を免疫学的手法により観察した結果、カルシウムイオン濃度の低下により染色体が膨らむにもかかわらず、動原体の外板や内板に位置するタンパク質の局在には影響しないことが分かった。一方で、動原体の冠状繊維の構成因子のひとつであるCENP-Fの消失が観察された。
このことから、カルシウムイオンがCENP-Fの動原体への局在を制御する因子であると予想される。CENP-Fが消失した不完全な動原体は、微小管との結合を確立・維持することが困難になって動原体微小管が不安定化し、染色体の整列異常が引き起こされると考えられる。
今回、カルシウムイオンが染色体の動原体タンパク質であるCENP-Fの局在を制御する因子であることが明らかとなった。これは、分裂期の染色体の挙動がカルシウムイオン濃度によって調節されていることを示している。
研究グループは今後、カルシウムイオンがどのようにしてCENP-Fの局在を制御しているのかを追究し、生物がゲノムを安定して維持する機構の解明を目指し、また、疾患細胞を用いてカルシウムイオン濃度や染色体の挙動を測定することで、カルシウムイオン濃度の異常がヒトの健康に与える影響についても調べるという。これらにより、細胞のがん化などを防ぐための新たな手掛かりを得ることを目指すとしている。