理化学研究所(理研)は8月24日、腸管上皮細胞において、細胞内タンパク質輸送因子「AP-1B」が正常に機能しないと、腸管粘膜の異常増殖が引き起こされるという仕組みを発見したと発表した。
同成果は理研 統合生命医科学研究センター 粘膜システム研究グループの大野博司グループディレクター、長谷耕二客員主幹研究員(現 東京大学医科学研究所特任教授、JST戦略的創造研究推進事業さきがけ研究員兼務)、中津史 研究員(現 米イェール大学医学部アソシエートリサーチサイエンティスト)らによるもの。詳細は米国消化器学会発行の専門誌「Gastroenterology」(9月号)にオンライン掲載された。
細菌やウイルスなどの異物と接する生体の表面は、皮膚や粘膜によって保護されており、特に体の表面を覆う表皮の場合、重層する表皮細胞や角質層によって比較的堅牢な防壁を形成し、異物の侵入を食い止めている。一方、消化器官といった臓器の粘膜面は、その多くが単層の粘膜上皮細胞で覆われているだけの脆弱な防御機能であり、特に腸管粘膜は、主たる機能である栄養や水分の吸収効率を高めるために、約400m2という広さを有している関係上、食物に含まれるアレルギー物質や、食物とともに摂取される外来微生物、数百兆個とも言われる腸内常在細菌叢などの異物に常にさらされていることとなっている。
そうした腸管粘膜の最前線にある腸管上皮細胞の細胞膜は、腸管内腔に面する「頂端面」と体内に面する「側底面」という2つの区画に明確に分けられ、それぞれに異なるタンパク質群が存在し、体の内と外という異なる環境を隔てる細胞として必要な機能を発揮している。また、同細胞は、さまざまな異物と常に接するため、免疫細胞とならび体内でももっとも盛んに分裂増殖を繰り広げており、ヒトの場合、約5日間ですべての細胞が入れ替わることが知られている。
1つの細胞の中で部位により構成タンパク質の組成やそれに伴う機能が異なる現象「細胞の極性」と呼ぶが、腸管上皮細胞はその極性を形成・維持しながら増殖・分裂を行っていく必要があるため、細胞極性と細胞増殖が密接に関連しながら制御されていることになるが、これまでその分子メカニズムは未解明であった。
そこで今回、研究グループでは、上皮細胞だけに存在し、特定のタンパク質を輸送して側底面の細胞膜に局在させる因子「AP-1B」に着目し、研究を実施。
具体的には、AP-1B遺伝子を腸管上皮細胞だけで欠損させたマウス(AP-1B欠損マウス)を作製し、その表現型を病理組織学的、生化学的に解析を行った。その結果、AP-1B欠損マウスでは通常ほとんど死亡しない若齢(8週齢以前)での死亡率が約50%と異常に高く、生き残ったマウスでも、体重減少、小腸からの栄養吸収の低下、低血糖、低アルブミン血症、成長不良が認められたという。
また、同マウスでは腸管上皮細胞のタンパク輸送の極性に異常があることも発見したほか、小腸の重量が通常の3倍ほどであること、ならびに腸管上皮細胞の過剰な増殖が認められたという。
これらの観察結果を、さらに詳細に解析したところ、AP-1Bが失われたために、通常では側底面に局在して細胞間接着として働いている細胞接着分子「E-カドヘリン」が細胞内の顆粒に蓄積していることが判明したほか、本来E-カドヘリンと複合体を形成して細胞間接着を制御している「β-カテニン」の結合が不安定となっていることが判明したとする。

|
|
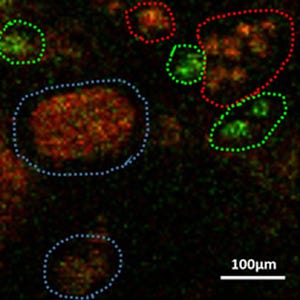
AP-1B欠損マウスの腸管上皮細胞におけるE-カドヘリンの局在異常。正常な対照マウス(Ap1m2+/-、左の図)ではE-カドヘリン(緑)は側底面細胞膜に局在するため線状に染色されるが、AP-1B欠損マウス(Ap1m2-/-、右の図)では線状の染色に加え、細胞内顆粒への異常な蓄積が認められた(矢頭)。赤紫部分はDAPIというDNAと結合する試薬により核を描出したもの(スケールバーは10μm) |
また、β-カテニンは分化した細胞における細胞間接着の機能だけでなく、未分化な幹細胞では増殖因子の転写活性化を介して細胞増殖に働く役割を持っており、AP-1B欠損によるE-カドヘリンとの結合が不安定となった結果、細胞質から核内にβ-カテニンが移行することで本来増殖しない分化した細胞においても細胞増殖に働く遺伝子の転写が上昇し、腸管上皮細胞が過剰に増殖することを発見した。
この結果は、AP-1Bがこれまで不明であった腸管上皮細胞の極性と増殖を結びつける因子として、その両者を制御していることを示すものであると研究グループでは説明する。
なお、これら一連の結果から研究グループでは、AP-1Bが腸管上皮細胞の極性と増殖を制御していることを踏まえ、腸管上皮細胞のがん化との関連が示唆されたとしており、すでに実際にマウスやヒトの大腸がん検体を用いた神戸大学や金沢大学との共同研究から、それを裏付ける結果も得ているという。そのため、今後は、こうした研究をさらに発展させることで、将来的にAP-1Bを標的とした新たながんの早期発見法や予後の評価法の開発につなげたいとしている。