筑波大学は8月13日、肝臓内にグリコーゲン量の減少を感知する仕組みが存在し、その働きによって、絶食時のエネルギー源を肝臓のグリコーゲンから脂肪細胞のトリグリセリド(中性脂肪)に切り替えていることを発見したと発表した。
同成果は同大 医学医療系の矢作直也 准教授、東京大学 大学院医学系研究科糖尿病代謝内科の泉田欣彦 助教らによるもの。詳細は「Nature Communications」に掲載された。
肥満は、体内の脂肪細胞に過剰にトリグリセリドが蓄えられた状態であり、糖尿病や高血圧、脂質異常症などを併発しやすいことが知られているほか、動脈硬化の危険因子としても知られていることから、その対策が求められている。対策として、食事療法(ダイエット)などが有効であることが知られているものの、肥満の解消は容易でないことも良く知られるところとなっており、肥満防止に向けた脂肪の分解・燃料の機構解明ならびに、効率の良い脂肪燃焼方法などの解明などが求められていた。
今回、研究グループは絶食時にトリグリセリドがエネルギー源として分解され使われていくプロセスの研究に中で、脂肪組織のトリグリセリド分解が進むには肝臓からの神経シグナルが重要な役割を担っていることを発見した。
そこで、機構の解明に向けた詳細な研究として、迷走神経肝枝に外科的切離術(HVx)を行ったところ、絶食時の脂肪分解が減少し、脂肪組織が相対的に大きくなることを確認したほか、上行性の神経線維のみを破壊するカプサイシン処理(Cap)を施しても、同様の結果が得られることを確認しており、これにより絶食時の脂肪分解シグナルが迷走神経肝枝を経由していることが示されたとする。

|
|
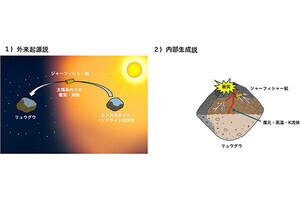
今回の研究で明らかにされた肝臓-脳-脂肪組織にまたがる神経性調節機構。絶食時に肝臓でグリコーゲン不足になると、肝臓から迷走神経(副交感神経)肝臓枝を通って中枢神経系へ情報伝達が行われ、そこからさらに交感神経を経由して脂肪組織へ神経シグナルが伝わることで脂肪分解が促進。その結果、炭水化物から脂肪へとエネルギー源が切り替わる |
また、この絶食時における迷走神経シグナルの起点を分子生物学的手法により探索していったところ、肝臓内グリコーゲン量の減少が引き金となっていることを発見。具体的には、グリコーゲン合成酵素(Gys2)をアデノウイルスベクターを用いて肝臓に過剰発現させ、肝臓のグリコーゲン量を増やしておくと、絶食時の脂肪分解が抑制されること、ならびにRNA干渉(RNAi)によりグリコーゲン合成酵素の発現を低下させグリコーゲン量を減らしておくと、脂肪分解が促進されることを確認したという。
さらに、グリコーゲン分解を司るグリコーゲンホスホリラーゼの発現量をRNAiにより低下させ、グリコーゲン分解を抑制したところ、グリコーゲン量が増加すると同時に、絶食シグナルが抑制され、結果として脂肪分解が抑制されることも判明。このことから、絶食時の迷走神経シグナルの起点になっているのは、グリコーゲンの分解によって生成される代謝物ではなく、グリコーゲン量そのものの減少であることが示されたと研究グループでは説明しており、これにより、脂肪をより効率的に燃焼させるためには、肝臓内グリコーゲン量を減らすことが有効である、という結果を得たとしている。
なお、研究グループでは今後、肝臓内グリコーゲン量を検知する仕組みについてのさらなる解明を目指した研究を進めるとしており、それにより食事療法によらない、肥満対策の新たな治療法の確立が期待されるとコメントしている。