京都大学iPS細胞研究所(CiRA)と科学技術振興機構(JST)は1月22日、ヒトiPS細胞を分化誘導させ、腎臓や生殖腺などの元となる「中間中胚葉」へと高効率で分化させることに成功したと共同で発表した。
成果は、CiRAの前伸一研究員、同・長船健二准教授(JST山中iPS細胞特別プロジェクト)らの研究グループによるもの。研究の詳細な内容は、英国時間1月22日付けで英国オンライン科学雑誌「Nature Communications」に掲載された。
腎臓は構造や発生機構が複雑であると同時に、老廃物の排泄や血圧の調節、赤血球の合成促進など生理学的に重要なさまざまな役割を果たしている。腎臓はいったん傷つくとその機能を修復することはほとんどできず、機能不全が進行すると人工透析により命をつなぐことになってしまう。
日本の透析患者数は2011年12月現在で30万人を超え、透析医療費は2009年で見た場合、全医療費18.6兆円の内の1.2兆円とおよそ6%を占めており、腎臓を再生する研究が切望されているというわけだ。
iPS細胞やES細胞を使って腎臓の細胞を誘導する試みが行われているが、ヒトのiPS/ES細胞を用いて腎臓の細胞を誘導する技術は現在までのところ完成していない。
これまでの発生生物学的研究から腎臓は中間中胚葉から発生することがわかっている。よって、iPS/ES細胞から中間中胚葉を高効率に誘導することが、腎臓の細胞へと誘導する上で最初の重要なステップとなるというわけだ。
目的の細胞で特異的に発現する遺伝子に蛍光タンパク質を導入することにより、目的の細胞に分化した細胞のみを見分けることが可能だ。しかし、これまでヒトiPS/ES細胞に相同組み換えによる遺伝子導入をする技術は難しく、容易にできるものではなかった。
そこで研究グループは、「BAC(bacterial artificial chromosome)ベクター」と「SNP(single nucleotide polymorphism)アレイ解析」を用いて、ヒトiPS/ES細胞のゲノムに効率よく相同組み換えを行う技術を確立。
この技術を用いて、中間中胚葉の分化マーカー遺伝子であるOSR1にGFPを導入し、中間中胚葉に分化した細胞のみGFPが発する光により検出できる評価系を構築したのである。
この細胞の評価系を利用し、ヒトiPS/ES細胞から中間中胚葉へと分化させる最適な方法が次に検討された。そして研究グループは、さまざまな成長因子の内、「BMP7(bone morphogenetic protein7)」、「activin A」および「Wnt3a」を細胞に作用させることにより、中間中胚葉へと高効率に分化誘導できることを明らかにしたのである。
さらに、低分子化合物「CHIR99021」を用いて分化させる効率を高め、分化誘導後11日目には90%以上の細胞がOSR1を発現し、中間中胚葉に分化していることが確認された(画像1)。
画像1は、ヒトiPS/ES細胞から中間中胚葉へと分化した細胞の割合の推移。分化誘導後、中間中胚葉の指標であるOSR1を発現している細胞の割合が増加し(画像内で赤点の集団が右側へとシフト)、11日目には90%を超える細胞が中間中胚葉へと分化したと読みとれる具合だ。
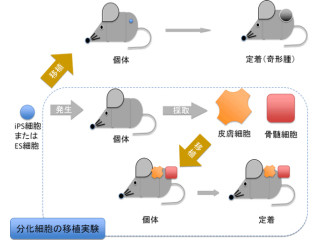
次に、樹立した中間中胚葉をマウス胎児の腎臓細胞と共培養したところ、一部の細胞で管状の構造を形成したものがあり、その細胞は腎尿細管のマーカーである「LTL(Lotus Tetragonolobus lectin)」が陽性であり、かつ、尿細管上皮細胞の指標である「LAMININ」を発現していることも確認された。
従って、今回確立した方法でヒトiPS/ES細胞から誘導した中間中胚葉には、腎臓の3次元構造を作る能力があることが示されたのである(画像2)。
画像2は、中間中胚葉から誘導した一部の細胞で腎尿細管の構造を形成したところを撮影したもの。管構造を形成した細胞はLAMININおよびLTLが共に陽性であり、腎尿細管であると考えられる。画像中の緑色の部分はヒトミトコンドリア(ヒト中間中胚葉由来の細胞であることを意味する)、青は核、紫はLAMININ、赤はLTL、図中のバーは50μmを示す。
今回の研究では、容易にヒトiPS/ES細胞のゲノムに蛍光タンパク質を相同組み換え法にて、遺伝子導入する方法が確立された。この技術により、目的の細胞になっているか否かを評価できるシステムを構築し、効率のよい分化誘導方法が開発されたのである。
最終的に、3種の成長因子と化合物の組み合わせで、高効率にヒトiPS細胞から腎臓の元となる中間中胚葉を誘導できることを明らかにした。また、これらの細胞から腎尿細管の構造を作製することににも成功した形である。
次のステップとして、ヒトiPS/ES細胞由来の中間中胚葉細胞を腎臓の細胞へと、効率よくなおかつ特異的に分化させる方法を開発する必要があると、研究グループはコメント。
さらに、中間中胚葉は腎臓・副腎・生殖腺の3種に分化することが知られており、腎臓のみならず、副腎や生殖腺の再生医療にも応用が期待されるとしている(画像3)。