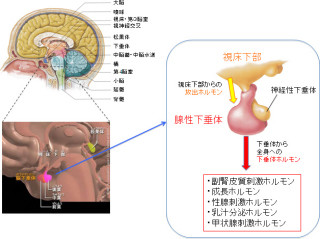
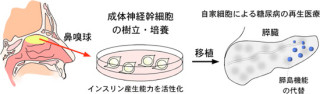
名古屋大学(名大)は、ヒト脱落乳歯や親知らずから採取した「歯髄幹細胞」を用いることで、新たな脊椎損傷治療を確立できる可能性があることを発表した。さらに、歯随幹細胞が3つの再生メカニズムを発揮することで、中枢神経を再生することも明らかにしている。名古屋大学医学系研究科顎顔面外科学の上田実教授らの研究グループによるもので、成果は米臨床研究学会誌「The Journal of Clinical Investigation」電子版に掲載された。
脊椎損傷は一度損傷すると修復・再生されず、病態は複雑だ。外傷などによる一次損傷は、神経伝達物質や「炎症性サイトカイン」の異常放出を引き起こし、それによってより広範囲な脊髄細胞のアポトーシスやネクローシス死(二次損傷)を誘発してしまう。
損傷部位に集積した「アストロサイト」は細胞外基質を産生し、損傷部位を囲い込むように「グリア瘢痕」を形成する。グリア瘢痕は、炎症性因子や神経伝達物質の拡散を防ぐ「生体防御システム」として機能する一方で、再生しようとする脊髄神経細胞の神経軸索慎重を阻害し、中枢神経の再生を妨げてしまうというマイナスの面も持つ。
急性期の脊髄損傷では、これら多様なファクターが複雑に絡み合うことによって不可逆的な機能不全が引き起こされてしまう。この多面的な病態の改善に有効な治療法はまだ開発されていないのが現状だ(画像1)
近年、脊髄損傷の多面的病態に有効な治療法として、幹細胞移植による治療が注目を集めている。これまでの研究においては、ヒトES細胞、iPS細胞、骨髄間葉系幹細胞などの治療効果が脊髄損傷の動物モデルを用いて解析されてきた。これらの細胞は失われた細胞を補給する効果と、細胞から分泌される再生因子によって治療効果を発揮すると考えられている。
しかし、分泌因子は多様であり、その再生メカニズムの実態は多くが不明のままだ。また、実用化に関しては倫理面や移植安全性、移植細胞の低い生着効率、治療効果の曖昧性、幹細胞採取における激しい生体侵襲など多くの問題を抱えている状況である。これらの問題をクリアした、新しい幹細胞ソースの開発が期待されているというわけだ。
そこで注目されているのが、ヒトの歯随組織である。ヒトの歯随組織は、葉の内部空洞(歯随腔)を満たす軟組織であり、神経・血管・結合組織、象牙質の栄養や修復を担う象牙芽細胞などで構成。歯随組織は胎生期の頭部神経外胚葉から分化した神経堤細胞に由来すると考えられている。もともと神経系の細胞であったため、神経再生治療に有用である可能性が高いと考えられてきたのである。
しかし、特定の神経疾患に対する歯随幹細胞の治療効果は多くが不明のままだった。そこで今回、研究グループは脊髄損傷などの中枢神経損傷疾患に対する歯随幹細胞治療効果を検証したのである。
研究グループが、完全に切断したラット脊髄に歯随幹細胞を移植したところ、下肢運動機能が回復することを見出した。生後12週のラットの胸部脊髄を完全切断・利ダンすることで重度の脊髄損傷モデルとし、その切断部周囲と切断面にヒト歯随幹細胞を移植。結果、移植後8週間で下肢3関節を回転させて歩行できるまでに回復したのである。
なお、骨髄由来の間葉系幹細胞や皮膚繊維芽細胞を移植したラットは歩行ができなかった。移植した歯随幹細胞の30%以上が生着し、その90%程度が成熟型オリゴデンドロサイトに分化し、軸索を覆っていて神経パルスの電導を高速化する機能を持つ「髄鞘」(別名ミエリン鞘)の再生に寄与することを見出している(画像2・3)。
ヒト歯随幹細胞は、骨髄由来の間葉系幹細胞と比較して3倍ほど高い細胞増殖能を示しており、マーカー発現や分化能の解析により、歯随幹細胞が神経外胚葉と中胚葉の正確を兼ね備えた幹細胞であることが判明。効果としては、大きく以下の3つが明らかとなった。
(1) 神経保護(アポトーシス抑制)効果:神経損傷では、受傷後、24時間で多くの神経細胞、アストロサイト、オリゴデンドロサイトがアポトーシスで消失してしまう。これが、損傷後の神経繊維や髄鞘の広範な破壊を引き起こす主たる原因だが、歯随幹細胞はこれらすべてのアポトーシスを強力に抑制。アポトーシスで死ぬ細胞の総数は、歯随幹細胞の移植によって1/10以下にまで減ることが確認された(画像4)。

|
|
画像4。歯随幹細胞による脊髄損傷のアポトーシス制御。神経損傷では、受傷後24時間で多くの神経細胞、アストロサイト、オリゴデンドロサイトがアポトーシスで消失する。歯随幹細胞はこれらすべてのアポトーシスを協力に抑制する。アポトーシス細胞の総数は歯随幹細胞移植によって1/10以下に現象 |
(2) 抗-軸索伸長抑制因子効果:中枢神経の損傷部位に形成されたグリア瘢痕は神経再生を抑制するが、歯随幹細胞から分泌される因子は、グリア瘢痕由来の軸索伸長抑制分子の効果を抑制し、脊髄神経の再生を促す機能を持つ。実験ではラットの大脳皮質運動野に順行性トレーサーを注入した後、2週間後に屠殺、トレーサーでラベルされた大脳皮質脊髄路の神経軸索を組織化学的に検出した。歯随幹細胞を移植した脊髄では、切断された軸索が切断面を超えて尾側脊髄に再生・伸長しているのが確認されている(画像5)。
さらに、損傷部周囲の頭側グリア瘢痕内に大量の神経繊維が侵入していることも注目すべき点だ(画像5の▼)。ほかでは頭側グリア瘢痕内に神経軸索が侵入できないし、軸索が切断面を超えることもなく、歯随幹細胞が損傷した脊髄の再生を促す環境を作り出すことも判明した。
(3) 細胞補給効果:中枢神経では髄鞘によって神経伝達速度が維持されているが、神経が損傷すると髄鞘を形成する細胞「オリゴデンドロサイト」が消失してしまう。脊髄損傷部位に移植した歯随幹細胞は、オリゴデンドロサイトに特異的に分化し、髄鞘の再生に貢献する。
この3つの効果の中でも、特筆すべきは(2)および(3)で、ほかの成体幹細胞では報告のない、特異的な神経再生能力であるという点だ。実際、歯随幹細胞移植による下肢運動機能の回復効果は、ラットによって骨髄由来の幹細胞より強力であることが明らかとなっている。さらに、歯随幹細胞は不要となった組織から採取可能であるため、幹細胞採取による生体侵襲はほぼ無視できる、という点も大きい。また、ラット脊髄に移植した歯随幹細胞の腫瘍形成能は検出されなかった点も優れた点の1つだ。
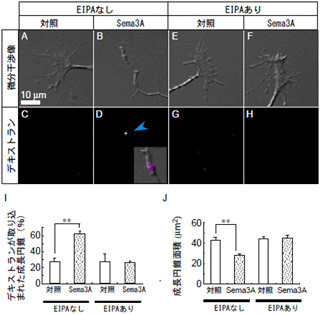
また研究グループは、グリア瘢痕の主成分である「コンドロイチン硫酸プロテオグリカン」(CSPG)が軸索伸長抑制因子として機能することが知られていることから、歯随幹細胞から分泌される未知の神経再生因子とCSPGとの直接的な関わり合いの検証も、試験管の中で行った。
ラット小脳から採取した神経細胞を培養すると神経突起を伸ばしていくことが判明。しかし、CSPGをコーディングした培養皿の上では突起を伸ばすことができなかった。そこに歯随幹細胞の無血清培養上清を加えると、神経細胞の突起伸長の回復することが見られたのである。なお、骨髄間葉系幹細胞や皮膚繊維芽細胞の培養上清には同様の効果が検出されていない点が重要だとした(画像6)。

|
|
画像6。歯随幹細胞の抗-神経軸索伸長阻害因子効果。神経細胞はプロテオグリカン(グリア瘢痕の主成分)の上で培養すると神経突起を伸ばすことができない。しかしながら、歯随幹細胞の無血清培養上清を加えると、突起伸長が回復。骨髄間葉系細胞や皮膚繊維芽細胞の培養上清にはこの効果はない |
研究グループは、今回の成果は、有効な治療方法のない脊髄損傷の治療に、腫瘍形成が確認されない危険性のない新しい可能性を提供できるだけでなく、医療廃棄物の有効利用にも道を開く画期的な研究成果であるとしている。なお、今後は前臨床研究として、サルの脊髄損傷モデルへの移植実験を行う予定だ。