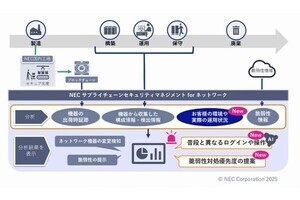
東京大学大学院工学系研究科 応用化学専攻の野地博行教授ならびに同応用化学専攻の飯野亮太講師らによる研究チームは、高速原子間力顕微鏡を使い、たんぱく質ナノモーター「F1-ATPase」が、回転子がなくても一方向に"回転"することを証明した。
同成果は、一方向への回転には回転子と固定子の相互作用を必須とする従来の説を覆し、他のたんぱく質ナノマシンの作動メカニズムの理解を助けるとともに、人工ナノマシンを設計する上で重要な指針を与えるものと研究チームでは説明しており、米国の学術雑誌「Science」に掲載された。
アデノシン-3-リン酸(ATP)合成酵素の一部であるF1-ATPaseはたんぱく質でできたナノメートルサイズの回転モーターで、ATPをエネルギー源として回転することは、1997年に日本の研究グループにより光学顕微鏡を用いた1分子観察で証明されている。F1-ATPaseの研究は日本がリードしており、これまでに、エネルギー変換効率(100%)、発生する回転力、最高回転速度(1秒間に数100回転)、回転ステップの大きさ(120°ごとに停止するステッピングモーター)などの基本的な性質が明らかにされている。
また、F1-ATPaseの立体構造をもとに、一方向に回転する仕組みについても議論が進められてきている。F1-ATPaseは、αとβサブユニットが3つずつ互い違いに並んで作る固定子リングに、回転子のγサブユニットが突き刺さった構造で、3つのβサブユニットが、"開いた状態"と"閉じた状態"に形を変化させることで、回転力を発生させている。これまでで最も有力な回転機構のモデルは、1つのβの形の変化が回転子γを通して別のβに伝わることで、3つのβが形を変えてトルクを発生する(γを押し引きする)タイミングがうまく調節されて一方向に回転するというものであった。しかし、最近、回転子γを短く削ってβとの接触点を大きく減らしても一方向に回転できるという報告がなされ、このモデルが必ずしも正しくはない可能性が示唆されていた。
今回、研究チームでは金沢大学の安藤敏夫教授、内橋貴之准教授が開発した高速原子間力顕微鏡を用いた1分子観察で、回転子のないF1-ATPaseの固定子リングが一方向に"回転"できるのかを検証した。その結果、ATP依存的に固定子リングの3つのβが順番にかつ反時計回りの一方向に構造変化する様子を明確に可視化することに成功し"回転"を実証することに成功した。
この結果はF1-ATPaseの回転の仕組みを明らかにしただけではない成果をもたらすという。特にF1-ATPaseに似たリング状の構造を持つものの、回転子サブユニットを持たないたんぱく質ナノマシンが数多く存在しており、これらの多くは、DNA複製のための二重らせん構造の解きほぐし、生合成されたたんぱく質が正しい立体構造をとる手助け、不要なタンパク質の分解など、細胞の多彩な機能を担っており、回転子がなくても回転するという結果は、これらのナノマシンも同様に、リングを形成するサブユニット同士が協調して働くことを示唆するものであると研究チームでは説明している。
また、F1-ATPaseは固定子リングだけで回転することから、カーボンナノチューブなどの回転子γと同程度の大きさの人工物を代わりに突き刺せば、一方向に回転させることができると考えられるため、こうしたたんぱく質と人工物のハイブリッドモーターができれば、将来、光に応答して回転し有用な化合物を合成するナノマシンなどを創り出せる可能性があるという。