生理学研究所(生理研)は、ヒトの上皮細胞で、周囲の体液濃度が高まって「高浸透圧(ハイパー)」になった時にイオンの通り道となり、細胞が縮んでしまうことを防ぐ分子(イオンチャネル)は、「TRP(トリップ)チャネル」の1種であることを発見、さらにこの分子が働くことで、細胞が縮まないようになり、死なずに済むというその分子メカニズムを明らかにしたと発表した。
成果は、生理研の岡田泰伸所長、京都大学の森泰生教授、同・沼田朋大助教、ドイツ・マックスプランク研究所のフランク・ヴェーナー教授らによる国際共同研究グループによるもので、詳細な研究内容は英生理学雑誌「ジャーナル・オブ・フィジオロジー」3月1日号に掲載された。
ヒトの体を作る細胞は、常に一定の大きさを保っている。例え、激しい運動による脱水、過剰な塩分や大量な水の摂取などにより引き起こされる体液の浸透圧変化によって細胞の大きさの変化を強いられたとしても、細胞自らが環境の変化を感じて大きさを一定にするように調節する仕組みを持つ。
細胞の大きさの調節には、細胞内外でイオンの出し入れを行って(水を移動させて)いることは知られていたが、細胞の膜のどの穴、つまり「イオンチャネル」を通っているのか、そのイオンチャネルの分子についてはわかっていなかったのである。
今回、研究グループが発見したのは、温度などに対するセンサー分子として知られているTRPチャネルの一種。中でも、「TRPM2(トリップ・エムツー)」チャネルの1種である「TRPM2ΔC(トリップ・エムツー・デルタシー)」チャネル=「C末端細胞質Nudix領域一部欠失スプライスバリアント」が、ハイパーでも細胞が縮むのを防ぐイオンの通り道となる分子であることが確認されたのである。
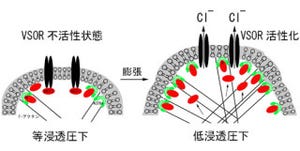
実験においてヒトの上皮細胞の周囲の液をハイパーにすると、イオンの流れ(電流応答)が増大した(画像1)。遺伝子クローニングによる解析を行ったところ、この電流応答は、TRPM2ΔCチャネルによるものであることが明らかとなったというわけだ。さらに、このTRPM2チャネルの働きを抑えると、電流応答も小さくなることがわかったのである(画像1の右グラフ)。
さらに研究グループは、このTRPM2ΔCチャネルは、HIV感染やがん、II型糖尿病、オキシトシン分泌などに関与する分子である「CD38(サイクリックADPリボースヒドロラーゼ)」と結合して相互作用をすることで活性化されるという、新たな分子メカニズムを解明した。
TRPM2ΔCチャネルとCD38分子は同じ細胞に存在し、細胞表面の膜の近くで、相互作用していたのである。画像2の左の写真の緑がTRPM2チャネルで、赤がCD38分子。両方ともに同じ細胞にある。
画像2の右の写真は、TRPM2チャネルとCD38分子の細胞中での相互作用の様子。写真の青色の部分は相互作用していることを示しており、2つの分子が細胞表面の膜近くで相互作用していることがわかるというわけだ。
トリップがハイパーを感じる仕組みは、まず細胞の周囲の液が高浸透圧になるとCD38が働くことから始まる。これによって同じ細胞表面の膜上で寄り添うようにして存在しているTRPM2ΔCチャネルが、細胞の外から内へイオン(Naイオン)を流し、細胞が縮みっぱなしになることを防いでいるという仕組みだ(画像3)。
岡田所長は、今後、多くの病態の解明・治療に寄与するものとして期待されるとのべている。特に、体液浸透圧維持不全が原因として関与する高ナトリウム血症や、ある種の高血圧症、高血糖高浸透圧症候群、心筋梗塞などの疾患の発生メカニズムの解明にも波及することも期待されるという。
さらに、前述したようにCD38が関わることから、HIV感染やがん、II型糖尿病、オキシトシン分泌(その不全の自閉症などの発達障害)などの疾患との関連性についても今後、研究の発展が期待されるとした。