理化学研究所(理研)と九州大学(九大)の研究グループは、免疫系細胞に特異的に発現して免疫応答を制御する鍵となる「DOCK2(dedicator of cytokinesis 2)タンパク質」と、その結合タンパク質である「ELMO1(engulfment and cell motility 1)タンパク質」の複合体の立体構造を決定し、2つのタンパク質が結合することでそれぞれの機能を自己抑制している状態から、互いの機能を発揮できる状態へと移行させていることを明らかにした。同成果は、理研生命分子システム基盤研究領域の横山茂之領域長、白水美香子上級研究員、新野睦子上級研究員、塙(末次)京子研究員と、九大 生体防御医学研究所の福井宣規教授、錦見昭彦助教、神田大輔教授らによるもので、2月13日の週に米国科学アカデミー紀要「The Proceedings of the National Academy of Sciences USA (PNAS)」(オンライン版)に掲載予定。
免疫システムは、感染による病原体やがん細胞などから身体を守るうえで必須の防御機構だが、身体を守るはずの免疫システムが自身を攻撃する自己免疫疾患や臓器移植の際に免疫システムによって引き起こされる移植片拒絶の問題は、現代医学が直面している課題となっている。
すでに福井教授らの研究グループは2001年に、DOCK2が免疫系細胞に特異的に発現し、免疫応答を制御する鍵となるタンパク質であることを明らかにしていた。DOCK2は、Racタンパク質を活性化させ、アクチンの重合を誘導し、免疫系細胞の運動や活性化を制御する。自己免疫疾患や移植片拒絶は、免疫系細胞が標的臓器に浸潤し、活性化されることで引き起こされる病態であり、DOCK2はこれら免疫難病をコントロールするための分子標的となる可能性があり、実際の研究グループの研究では、DOCK2欠損マウスに心臓移植すると、免疫抑制剤を使用しなくても心臓が長期にわたり働き続けることが確認されていた。
DOCK2は、DOCKファミリタンパク質に特有のDHR2ドメイン(DOCKhomology region 2 domain)を持つが、このドメインは、Racタンパク質に結合しているGDP(グアノシン二リン酸)をGTP(グアノシン三リン酸)に変換することで、Racを活性化する。この反応は免疫応答のシグナルを伝達するために必要不可欠であることが明らかにされている。
DOCK2は試験管内ではDHR2ドメインだけでRacを活性化させる機能を発揮するが、実際の細胞内ではDOCK2結合タンパク質であるELMO1がないとその機能を発揮することができないことが判明しているが、なぜそのELMO1がないとDOCK2が細胞の中で働くことができないかは謎のままであった。そこで今回、研究グループは、自己免疫疾患や移植片拒絶などの難治性免疫疾患に対し、DOCK2を標的としたこれまでにない新しいアプローチの治療薬、予防薬などの創生の道を切り開くため、DOCK2とELMO1 の複合体の構造解析に取り組んだ。
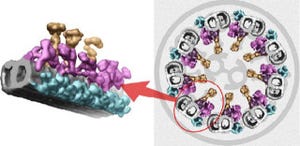
具体的には、大きなタンパク質であるDOCK2(1830個のアミノ酸で構成)とELMO1(727個のアミノ酸で構成)が相互作用する領域の探索を行った。探索では、独自に開発した無細胞タンパク質合成系を用いてスクリーニングを行い、DOCK2のN末端とELMO1のC末端とが結合することで安定な複合体を形成することを見いだした。また、その領域を用いてX線結晶構造解析に適した試料を調製、結晶化し、放射光科学研究施設PF(Photon Factory)および大型放射光施設SPring-8でX線回折を実施、その結果、複合体の立体構造を2.1Åの分解能で決定することに成功した。
ELMO1のC末端にはアミノ酸の1つであるプロリンが連なった領域(PxxP)があり、DOCK2のN末端にはこのプロリンと結合することができるSH3(SRChomology 3)ドメインがあるため、これまでこの領域が2つのタンパク質を結合させていると考えられていた。しかし、解析の結果、実際の構造はそのような単純なものではなく、ELMO1のC末端はDOCK2のSH3ドメインを取り囲むように結合していることが判明したほか、DOCK2とELMO1のアルファへリックス同士が結合し合い、計5本のアルファへリックスから作られるヘリックスバンドルを形成し、全体としてDOCK2とELMO1の複合体は強固な構造体を形勢していることが判明した。
さらに構造情報に基づきDOCK2の機能解析を行った結果、単体のDOCK2は、折り畳まれた形で存在し機能を自己抑制していることが判明。単体のELMO1も同様に、折り畳まれた形で存在し自己抑制していることがすでに知られている。DOCK2の折り畳まれた形の形成には、32番目のグリシンが重要であることが推測されていたが、DOCK2とELMO1の複合体では、32番目のグリシンがELMO1と直接結合していることが分かった。またELMO1の折り畳まれた形の形成には、692番目のメチオニンと693番目のグルタミン酸が重要であることが知られていたが、複合体ではこれらはヘリックスバンドルの中央に存在し、それぞれのアミノ酸がDOCK2と結合していることも分かった。これは、DOCK2とELMO1が結合し複合体を形成すると、それぞれの折り畳まれた形の形成を担っていた部位が複合体結合部位となり、折り畳みを解くことを意味しており、この結果からDOCK2とELMO1は、単体ではそれぞれ折り畳まれた状態で機能を自己抑制しているが、複合体を形成することで折り畳み状態を解いて互いの自己抑制を解除し、それぞれ、DOCK2とELMO1複合体の細胞膜への移行を促進し、さらにDOCK2のRac活性化によりシグナルが伝達され、免疫系細胞の遊走や活性化が起きるという分子メカニズムの一連が明らかとなった。
研究グループでは、今回のの発見と立体構造情報により、他のDOCKファミリタンパク質によるさまざまなシグナル伝達のメカニズム解明が期待できるようになるほか、難治性免疫疾患に対する治療薬、予防薬創生のためのドラッグデザインが可能となり、新しい治療薬の開発につながることが期待できるとコメントしている。