今回の実験では、同デバイスを用いて、液体導入口に近い側から排出口に近い側へと順にアクチュエータを膨らませることで小腸組織を変形させ、それにより発生する流れの観察と解析が行われた。その結果、小腸組織の変形に合わせ、蛍光性マイクロビーズが多数の絨毛の間を縫うように移動したり、旋回したりする様子が観察されたという。
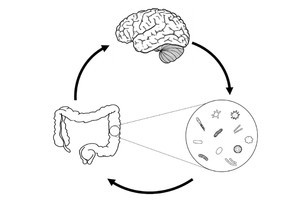
研究チームによると、ビーズは、絨毛を這うようにゆっくり流れる群(Group1)、絨毛近傍で減速する群(Group2)、速度を落とさず通過する群(Group3)に分類でき、絨毛に辿り着く流れの候補が絞り込めたとのこと。小腸では微生物や食物、消化液などがかき混ぜられるといわれているが、旋回流はそれに関連する可能性があるとしている。
これまで謎の多かった“体外から摂取された善玉菌が小腸細胞に到達するための機構”を直接観察できるようになれば、善玉菌を効率的に絨毛表面の細胞に送達するための条件の解明につながることが期待される。さらに、特定した流れをうまく活用することや錠剤の形状を設計することで、高効率なプロバイオティクスや特定免疫防御機能の活性化法の開発実現性が高まると考えられるという。
研究チームは今後、実験で用いる小腸内環境を生体内にさらに近づけていく予定とする。たとえば、変形モードを生体内の蠕動運動のように設定し、腸内を粘膜と同粘度の人工粘液に置換した上で常在菌を培養し、蛍光ビーズを乳酸菌に置き換えたりすることなどを考えているという。さらには、生命活動を維持した状態での小腸組織のデバイス化などを目指し、実際の小腸内で発生する善玉菌の絨毛表面の細胞への付着までの現象を解明するために研究を進めていくとしている。