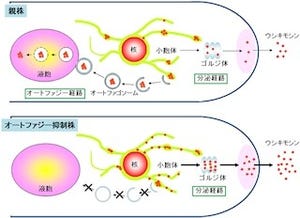
北海道大学(北大)は1月10日、アポトーシス(プログラム細胞死)を抑制的に制御する、細胞内セリンスレオニンキナーゼ「AKT」に結合する新規の結合因子である「Phafin2」が、真核生物の細胞内において不必要なタンパク質を分解するのに重要な小器官である「リソソーム」の膜上に存在する膜リン脂質「PI(3)P」と結合し、そのAKTをリソソームに誘導する現象こそが「オートファジー(自食作用)」を実行させるのに必須であることを明らかにしたと発表した。
成果は、北大 遺伝子病制御研究所の野口昌幸 教授らの研究チームによるもの。研究の詳細な内容は、1月9日付けで米オンライン科学誌「PLoS ONE」に掲載された。
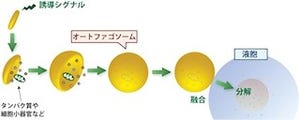
オートファジーは酵母からヒトに至るまでの真核生物に見られる、細胞自身が持つ細胞内タンパク質を分解するための仕組みの1つだ(「auto-」はギリシャ語で「自分自身」を表す接頭語、「phagy」は「食べること」の意)。この機構によって、細胞内の異常なタンパク質の蓄積を防いだり、過剰にタンパク質が合成された時や栄養環境が悪化した時にタンパク質のリサイクルを行ったり、さらには細胞質内に侵入した病原微生物を排除したりすることで、生体の恒常性維持などに関与している。このほか、個体発生の過程での「アポトーシス(プログラム細胞死)」にも関わっている機構だ。
また各種疾患にも関与しており、ハンチントン病などの発生、細胞のがん化抑制にも関わるほか、同機構のタンパク質分解系が異常を起こすと、精神神経疾患や悪性腫瘍、感染症など、さまざまな疾患を引き起こすことも知られている。
そんなオートファジーの誘導には細胞中の「PI3K」、「AKT」、「mTOR」間のシグナル伝達の関与が示唆されてきた。特にAKTに関しては、オートファジーにおいてリソソームを介したそのシグナルが関与していることは推測されている。しかし、その具体的な標的分子やその制御機構は十分に解明されていなかった。
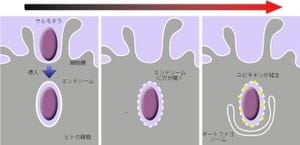
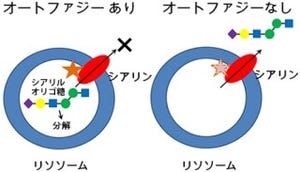
そこで研究チームが今回の研究で細胞死制御の要となるAKTに結合する新規の結合因子として同定したのが、リソソーマルタンパク質であるPhafin2だ。さらに分子免疫手法を用いて、研究チームはPhafin2がリソソーム膜に存在するPI(3)Pと結合し、AKTをリソソームに誘導する現象の生物学的な意義の解明が進められた。そして、Phafin2-AKT複合体がリソソーム膜に存在するPI(3)Pと結合し、その結果としてPhafin2-AKT複合体がリソソームに移行することが、生体のタンパク分解系の要であるオートファジー誘導に必須であることが判明したというわけだ。
今回オートファジーを制御する仕組みが明らかにされたことで、オートファジータンパク質分解系の異常が招く精神神経疾患や悪性腫瘍、感染症など、いまだ治療法のない疾病の新規治療への道標となる可能性があるとしている。