東京都医学総合研究所(東京都医学研)ならびに東北大学は9月6日、「オートファジー」と「Keap1-Nrf2経路」という2つの生体防御機構がp62タンパク質のリン酸化を介して連動していること、ならびに同機構をがん細胞が自身の増殖に利用していることを発見したと発表した。
同成果は、東北大学大学院医学系研究科医化学分野の山本雅之 教授、東京都医学研の一村義信 研究員、同 小松雅明 副参事研究員らによるもの。詳細は、米国科学雑誌「Molecular Cell」に掲載された。
栄養飢餓に応じた自己タンパク質分解を介したアミノ酸供給の一方、細胞内に生じた毒性のある異常構造体や細胞内に侵入した細菌を積極的に分解し細胞の恒常性を維持する機能である"オートファジー"は細胞質に出現した構造体が伸長して細胞質成分を取り囲んだオートファゴソームが形成される過程と、生じたオートファゴソームがリソソームと融合し内容物を消化する2つの過程から構成されていることが知られている。
またオートファジーに加え、細胞がストレスに曝された場合、ストレスを感知するセンサである「Keap1」が働き、転写因子として生体防御酵素群の遺伝子発現を誘導する「Nrf2」が活性化、抗酸化タンパク質や抗炎症性酵素の遺伝子発現が誘導され、細胞は保護される"Keap1-Nrf2制御システム"という生体防御機能も生物は有しているが、この2つの接点については、これまで不明のままであった。
これまでの研究から、「p62タンパク質」はストレスにより細胞内に生じた異常タンパク質凝集体や異常ミトコンドリア、さらに細胞内に侵入した細菌を認識し、それらをオートファゴソームに輸送する受容体であると提唱されてきた。今回の研究では、そうしたp62が異常タンパク質凝集体、異常ミトコンドリアや細胞内侵入細菌に集積するとリン酸化を受け、その結果p62とKeap1との結合が増強され、それによりNrf2が活性化するという機構を発見。これにより、オートファジーとKeap1-Nrf2経路がp62のリン酸化を介して連動していることが示されることとなった。
|
|
|
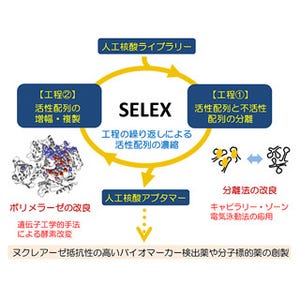
p62が異常たんぱく質凝集体、異常ミトコンドリアや細胞内侵入細菌に集積するとリン酸化を受け、その結果p62とKeap1との結合が著しく増強されKeap1が不活性化し、Nrf2が活性化する。その後、細胞毒性のある異常たんぱく質凝集体、異常ミトコンドリアや細胞内侵入細菌はオートファジーにより排除される |
具体的には、正常な細胞を用いた研究ではp62のリン酸化はストレス誘導時のみ観察されたが、肝細胞がん細胞株や肝細胞がん患者組織を用いた研究では恒常的にp62がリン酸化され、Nrf2が持続的に活性化されていることが確認されたという。中でも、肝がん細胞におけるp62のリン酸化を抑制したところ、がんの増殖が著しく抑制されたとのことで、この結果、p62のリン酸化やp62とKeap1との結合を標的とした化合物が肝細胞がんの新しい創薬候補になり得ることが示されたと研究グループでは説明する。
|
|
|
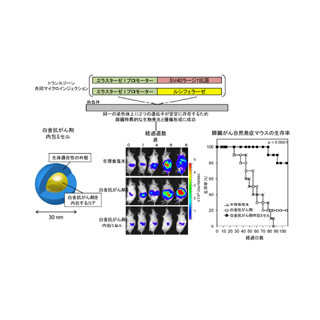
恒常的にp62がリン酸化、Nrf2が活性化されている肝細胞がんHuh1は高い腫瘍増職能を示した(左上)。また、Huh1細胞のp62を欠失させると増殖が著しく抑制されることも確認された(右上)。さらに、p62を欠失させたHuh1にp62リン酸化体を戻すと増殖が回復した(左下)が、p62リン酸化不能体を戻した場合は回復しないことも確認された(右下)。(スケールバーは各1cm) |
これらの結果から、p62のリン酸化やp62とKeap1との結合を標的とした化合物が新しい抗がん剤の創薬候補になることが期待されると研究グループでは述べており、現在、創薬オープンイノベーションセンター保有の化合物を用いて化合物スクリーニングを進めており、今後、p62を標的とした化合物が新しい抗がん剤の創薬候補になることが期待されるとしている。