福井大学、理化学研究所(理研)、東京大学の3者は9月12日、「Gタンパク質共役型受容体(GPCR)」の中でも約半数を占める嗅覚受容体ファミリーに着目し、遺伝子改変動物を用いた一連の実験から個々の「嗅覚受容体」が生み出す「基礎活性」が、嗅覚神経回路を形成する上で重要な役割を果たすことを見出したと共同で発表した。
成果は、福井大 医学部高次脳機能の中嶋藍 特命研究員、同・竹内春樹特命准教授、同・坂野仁特命教授、理研 発生・再生科学総合研究センターの今井猛チームリーダー、東大大学院 理学系研究科 生物化学専攻の西住裕文助教らの研究チームによるもの。研究の詳細な内容は、米国東部時間9月12日付けで米科学誌「Cell」に掲載された。
GPCRは細胞膜を7回貫通する特徴的な構造から、「7回膜貫通型受容体」とも呼ばれ、匂い・味・光といった外界の刺激や、ホルモン・神経伝達物質といった内因性の刺激を受容して、そのシグナルを細胞内に伝える。その際はGタンパク質と呼ばれる分子を介してシグナル伝達を行う。なお、GPCRはヒトで約800種見つかっており、全タンパク質中最大のスーパーファミリーを形成している。
そのGPCRの中でも約半数を占める巨大なファミリーが嗅覚受容体だ。ヒトでは約350種類、マウスにおいては約1000種類もの嗅覚受容体遺伝子が存在する。また、ヒトやマウスはその嗅覚受容体を用いて数10万種類もの匂い物質を識別することが可能だ。
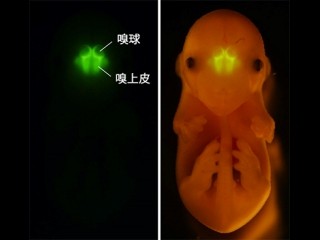
鼻腔の奥の「嗅上皮」と呼ばれる組織には、匂い分子検知センサの「嗅神経細胞」が約1000万個存在するが、それぞれは単一の嗅覚受容体を選択的に発現し、限定された匂い分子のみを検出する。嗅覚受容体によって検出された匂い情報は、電気パルスとして軸索を通り、大脳の最も前方に位置する「嗅球」へと入力される(画像1)。
嗅球には、「糸球」と呼ばれる構造が嗅覚受容体の種類に応じて約1000対存在しており、匂い情報の入力先となっている。従って、匂い情報は嗅球表面においては、約1000個からなる糸球を素子とする電光掲示板のような形で糸球の発火パターンとして画像化され、それを脳の中枢が読み取っているという。
この匂い情報を処理する嗅神経回路が構築される過程で、個々の嗅神経細胞で発現する嗅覚受容体が重要な役割を果たしている。このメカニズムに関しては、嗅覚受容体によって生み出されるシグナルの強度が軸索ガイダンス分子の発現量へと変換され、嗅神経回路の接続特異性を規定することが明らかとなってきた。しかし、約1000も存在する嗅覚受容体の種類の違いがどのようにして細胞内シグナルに反映されるのか、そのシグナルの起源が何であるのかは依然として不明のままだったのである。
これまでの研究から、嗅覚受容体によって入力されるシグナルが嗅神経回路の形成に重要であることは知られていたが、嗅神経回路の特異性は生まれ育った匂い環境によらず、個体間でよく保存されて形成されることから、嗅覚受容体がどのようにしてシグナルを入力しているのかも不明だった。
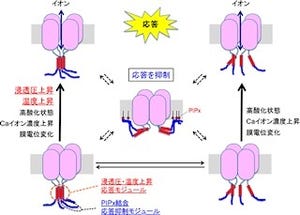
GPCRである嗅覚受容体はこれまでセンサとしての機能のみが注目されてきたが、近年、GPCRには刺激が存在しない状況下でも基礎活性が存在することが明らかになってきている(画像2)。そこで研究チームは、嗅神経細胞の回路形成は外界の匂い物質に依存しない嗅覚受容体の基礎活性によって制御されるのではないかという仮説を立てて研究が進められた。
刺激に依存しない嗅覚受容体の基礎活性が嗅神経回路の形成を制御するかを検証するためには、嗅覚受容体の基礎活性レベルを人為的に変化させ、嗅神経細胞の軸索投射にどのような影響が出るかを観察することが必要だ。そこで研究チームは、嗅覚受容体と相同性が高いGPCRである「β2-アドレナリン受容体(β2-AR)」をモデルに研究を進めることにした。
β2-ARは最も機能解析が進んでいるGPCRであり、基礎活性レベルに違いのある変異体が多数同定されている。さらに、β2-ARは嗅覚受容体と同様に嗅神経細胞の軸索投射を制御できることが報告されていた。これらの利点を活用し、研究チームはβ2-ARの基礎活性レベルを変化させた変異型β2-ARが嗅神経細胞で発現する遺伝子改変マウスを複数作製。
その結果、基礎活性の低い変異型β2-ARを発現する嗅神経細胞は野生型と比較して嗅球の前方に軸索を投射するのに対し、基礎活性の高い変異型β2-ARを発現する嗅神経細胞はより後方に軸索を投射したのである。この結果から、嗅神経細胞の投射先はGPCRの基礎活性に基づいて決定されることが示唆されたという(画像4)。
実際に嗅覚受容体の基礎活性が嗅神経細胞の軸索投射先と対応しているかどうかを確認するため、嗅球の前・中・後部に軸索を投射する嗅神経細胞で発現する嗅覚受容体についてそれぞれ基礎活性が測定された。その結果、嗅球前方に投射される嗅神経細胞で発現する嗅覚受容体の基礎活性は低く、嗅球後方に投射される嗅神経細胞で発現する嗅覚受容体の基礎活性は高い傾向にあることが判明したのである。
研究チームはさらにノックアウトマウスを用いた解析から、嗅覚受容体がセンサとして機能する時期と、基礎活性を使って機能している時期とでは異なるGタンパク質が嗅覚受容体のシグナルを伝えていることを見出した。嗅覚受容体が匂いセンサとして機能している成熟嗅神経細胞ではGタンパク質「Golf」が機能しており、基礎活性にはほとんど生じないのに対し、嗅神経細胞が軸索を投射している未成熟な時期では、Gタンパク質「Gs」が嗅覚受容体に作用して効率よく基礎活性を拾い上げ、「cAMPシグナル」産生に結びつけていることも明らかにしたのである(画像5)。
今回の研究およびこれまでの坂野グループの研究から、GPCRである嗅覚受容体が外部刺激に依存しない基礎活性によって、嗅神経回路の構築を制御していることが明らかになった。ヒトを含む高等動物の複雑な脳機能は、1000億個もの神経細胞が発生の過程で自身の細胞個性に従って互いにシナプスを形成し、精巧な神経回路網を構築することにより支えられている。そのため、神経細胞の個性がどのようにして規定され、特異的な回路構築を達成するのか、その機構の解明は神経発生学における一大テーマとなっているというわけだ。
今回、研究チームはマウス嗅覚系をモデルとして、嗅神経細胞の個性を規定するシグナルの起源がGPCRの基礎活性であることを明らかにした。この研究成果はほかの神経系にも応用できる可能性があり、複雑な脳のネットワークが構築される仕組みを理解する鍵になると期待されるという。一方、今回の成果はセンサとしての機能ばかりが注目されて来たGPCRが、刺激によらない基礎活性によって生理学的機能を果たすことを示した最初の例であり、創薬を始めとしたGPCRの研究分野に新しい切り口を与え得ると予想されるとしている。