理化学研究所(理研)は5月2日、複数種の放射性薬剤を同時に可視化する半導体コンプトンカメラ「GREI(Gamma-Ray Emission Imaging:グレイ)」を改良した「GREI-II」を開発し、生体内のタンパク質とミネラル(必須金属元素)の振る舞いを体外から高い解像度で同時に観察することに成功したと発表した。
成果は、理研 ライフサイエンス技術基盤研究センター 次世代イメージング研究チームの榎本秀一チームリーダー(岡山大学大学院 医歯薬学総合研究科教授兼任)、本村信治副チームリーダーらの研究チームによるもの。研究の詳細な内容は、英科学雑誌「Journal of Analytical Atomic Spectrometry」オンライン版に掲載される予定だ。
生きたままの個体を傷つけることなく、外部から生体内のタンパク質など分子の状態を可視化する分子イメージングやライブイメージング、バイオイメージングなどと呼ばれる技術は、疾患に関する定量的・客観的な指標を得る有力な手法であり、がんや認知症などの早期診断や根本治療に道を開く技術として期待が寄せられており、研究も活発である。
特に、放射性同位体の1種である陽電子放出核種の炭素11(11C)やフッ素18(18F)などで標識した分子プローブを用いるPET(Positron Emission Tomography:陽電子放出断層画像法)は、感度や定量性に優れた分子イメージング技術であり、さまざまな低分子化合物やタンパク質の分子動態を追跡する臨床応用が進んでいるところだ。
また、そうした低分子化合物やタンパク質以外にも生体内での状態を観察したいものとして、生命活動に必要な機能を維持するためのミネラルである亜鉛やカルシウムがある。こうした体内で微量にしか存在しないミネラルは、シグナル伝達や特定の分子が担う機能の調節に重要な役割を果たすなど、どれもなくてはならないものばかりだ。
研究チームは、これらの生体微量元素の働きを網羅的に分析する、RI(放射性同位体)トレーサー法の1種である「マルチトレーサー法」の開発・利用展開にいち早く取り組み、現在は種々の金属などの微量元素を中心として科学的な探究を行う「メタロミクス」と呼ばれる研究分野の創成にも貢献してきた形である。
メタロミクスとは、生体内に微量に存在する金属元素が、遺伝子発現、シグナル伝達、さらには種々の代謝反応に関わるタンパク質などに含まれ、それらの化学形態や含有量により生理機能に大きな影響を与えることから、種々の金属などの微量元素を中心として科学的な探究を行う研究分野のことだ。
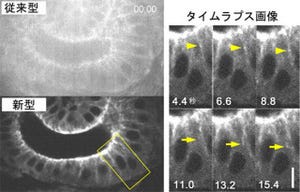
研究チームは2008年、独自に開発したガンマ線イメージング装置である半導体コンプトンカメラ「GREI」を用いて、3種の放射性薬剤を生きたマウスに同時投与し撮像実験を行った。なお半導体コンプトンカメラとは、シリコンやゲルマニウムなどの半導体放射線検出器内でガンマ線が「コンプトン散乱」という物理現象を起こして進行方向が曲がることを利用し、ガンマ線源の分布の視覚化を可能にしている。
研究チームはGREIを用いて薬剤が体内でリアルタイムに動く様子を確認し、さらに明確な画像でそれぞれ異なる挙動を示すことに成功した。GREIは、検出可能なガンマ線のエネルギー(波長)の範囲がほかの放射線画像法に比べて格段に広く、その波長を識別して可視化できる点が特徴だ。
GREIのこの特徴により、特定の分子に対するPETプローブと、必須金属元素を検出するための放射性同位体を同時に生体に投与し撮像して、その分子の状態と必須金属元素の挙動の関連性を正確な画像で調べることが理論的に可能となる。これらの成果や知見を基に、研究チームは分子イメージング技術と生体微量元素分析を融合した新しい研究領域を開拓してきたというわけだ。
なお当時のGREI-Iでは、PETプローブとそのほかの放射性同位体を同時に投与した撮像実験では、両者を明瞭に識別できないという解像度の面での問題があった。PETプローブに用いられる陽電子放出核種は半減期の短いものが多く、ある程度長時間の観察をするには、初期の投与量を十分に増やす必要がある。その結果、特に撮像開始直後のPETのシグナル強度が高くなり、不感時間(装置が処理を行っている間検出ができなくなる時間)が顕著に増加するため、同時に投与した放射性同位体の検出を妨げていた。
研究チームはGREI-IIを開発するにあたり、GREIの撮像ヘッド部であるゲルマニウム半導体検出器のガンマ線検出感度を向上させ、2.3倍にアップ。また検出データの転送速度を高速化することで、ガンマ線を1度検出する度に生じる不感時間を従来の600μsから90μs以下にまで短縮することにも成功した。その結果、GREI-IIでは、GREI-Iと同等の画質を得るために必要な撮像時間を10分の1以下にまで短縮でき、同じ撮像時間ではGREI-Iよりノイズの少ない高品質の画像を得られるようになったのである。
次にGREI-IIの実証実験として、がん細胞を移植したマウスの撮像実験が行われた。3種類のがん細胞株(「A431」、「4T1」、「C6」)を移植したマウスに、PETプローブとして銅64(64Cu)で標識した「抗HER2抗体」(がん遺伝子が作るタンパク質の1種で、乳がんなどの悪性化に関わる)と、必須金属元素の放射性同位体である亜鉛65(65Zn)の塩化物溶液を同時に投与し、11時間の連続撮像を実施。
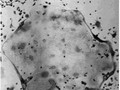
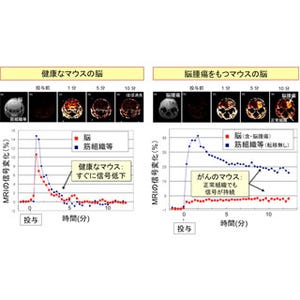
事前の検査で、A431にだけHER2タンパク質が高発現することを確認していたため、投与した抗HER2抗体がA431の腫瘍部位だけに集積することが期待された。撮像実験の結果、A431移植部位にPETプローブだけが集積し、肝臓へは65Znの集積する様子を同時に可視化することに成功したのである(画像2)。これらの移植細胞、臓器への集積は、撮像後に組織ごとの放射能を測定することでも確認された。
画像2は、GREI-IIによるがん細胞移植マウスの64Cu標識抗体・亜鉛同位体の同時撮像だ。(a)は3種類のがん細胞のA431、4T1、C6の移植位置。(b)64Cu標識抗体の分布画像。HER2を高発現するA431への特異的な集積が見られ、それ以外の移植がんには顕著なシグナルが見られない。なお体幹部のシグナルは肝臓を示している。(c)65Znの分布画像。主に肝臓への集積が見られ、移植がん細胞への特異的なシグナルは見られない。
疾患の原因となるような分子の異常が生じると、その分子の機能を調節している必須金属元素の挙動にも変化が生じている可能性があるが、従来のイメージング技術ではこれらの生体内の変化を同時にとらえることは不可能だった。GREI-IIは、ミネラル欠乏症など生体分子とミネラルが複合的に関与する疾患の病態を究明する新しい切り口を与えることが期待されると、研究チームはコメント。また、GREI-IIの有効性の検討、さらなる実用性能の向上を図り、創薬・医療に有用なライフサイエンス技術としてのGREI-IIの実用化を目指すことも語られた。