科学技術振興機構(JST)、医薬基盤研究所(NIBIO)、北九州市立大学(北九大)の3者は2月10日、インフルエンザなどの感染症に対する強力な「ワクチンアジュバント(免疫活性化分子)」の開発に成功したと共同で発表した。
成果は、NIBIOの石井健プロジェクトリーダー(大阪大学 免疫学フロンティア研究センター(FReC)ワクチン学招聘教授兼任)、同・小檜山康司 研究員(FReCワクチン学兼任)、北九大の櫻井和朗 教授らの共同研究チームによるもの。研究はJST課題達成型基礎研究の一環として行われ、詳細な内容は米国時間2月10日付けで米科学雑誌「米科学アカデミー紀要(PNAS)」オンライン速報版に掲載された。
ワクチンは病原体の感染や、感染による症状の重症化を防ぐために世界中で用いられている。ワクチンの中にはアジュバントと呼ばれる免疫活性化分子が含まれており、ワクチンの効果を高めるために80年以上もの長い間使用されてきた。これまでは、病原体由来の「リポ多糖(LPS)」やDNAやRNAなどの核酸などが実験的によく使用されてきたが、従来のアジュバントでは防ぐことのできない感染症も存在し、より効果的な新規ワクチンの開発には新たなアジュバントの開発が重要とされている。
またヒトの免疫システムには、「自然免疫」と「獲得免疫」があり、自然免疫は体内に進入した病原体に対して、観戦初期に迅速に対応するための防御反応で、以前にその病原体に感染したことがなくても排除できる、自然に備わっている能力だ。一方、過去に1度感染したことのある病原体が再び体内に侵入してきた場合には、過去の記憶に頼る強力で効率の高い獲得免疫によって防御反応を示す仕組みである。なお、自然免疫系が病原体の成分を特異的に認識すること、また感染後期の獲得免疫の誘導にも重要な役割を果たしていることが判明済みだ。
また、近年の自然免疫研究の発展から、ワクチンが十分な効果を示す(獲得免疫を活性化する)ためには、自然免疫の活性化が必須であることが明らかとなってきた(画像1)。そのため「自然免疫受容体」である「トル様受容体(TLR:Toll like receptor)」に結合する物質(リガンド)が、アジュバントとして期待され開発が行われている。
ちなみに自然免疫受容体は主に免疫細胞である「マクロファージ」や「樹状細胞」、「B細胞」などに発現しているタンパク質で、病原体の特異的な成分を認識し、免疫細胞活性化を誘導する役割を担う。活性化された細胞では病原体の貪食、排除が促進され、炎症性サイトカインなどを産生し、獲得免疫系への橋渡しを行っている。
そしてTLRはTLR1からTLR13までが報告されており、それぞれ認識できる病原体の成分が異なっており、認識することで自然免疫系を活性化することが可能だ。その13種類の中でも特にTLR9のリガンドである合成核酸「CpG ODN」(CpGは核酸のこと)は強く自然免疫を活性化することから、アジュバントのみならず抗がん薬や抗アレルギー薬としても期待されている。なおCpG ODNは、病原体には「CpGモチーフ」という、特殊な塩基配列が確認できるのだが、その特殊な塩基配列を持つ合成された核酸の総称だ。
CpG ODNはこれまでに大きく4種類(D型、P型、K型、C型)が報告されているが、効果の強いCpG ODNは凝集を起こすなど不安定であるために、実用化に向けての開発は困難だった。CpG ODNを幅広い免疫核酸医薬として応用するために、安定化によって効果を高くするための新たなアプローチが求められていたのである。
なお画像1は、獲得免疫の誘導には自然免疫活性化が必須であることを表したグラフと模式図。外来抗原のみ生体内に投与した時は、「シグナル1」が活性化されるが、「免疫寛容」となってしまう。一方で、生体内に病原体が感染した時や、ワクチンを接種することでシグナル1と同時にアジュバントによって自然免疫応答が活性化される(「シグナル2」)。この2つのシグナルが抗原提示細胞に入ることで、抗原特異的な獲得免疫応答を誘導することができるというわけだ。
そこで研究チームは今回、多糖(βグルカン)と合成核酸との複合体を形成させる独自技術を用いて、ヒトへの応用可能なワクチンアジュバントの開発を試みたのである(画像2)。

|

|
|
画像1(左):獲得免疫の誘導には自然免疫活性化が必須。画像2(右):核酸医薬と多糖の複合体作製技術。多糖(SPG)と核酸(CpG)が3重らせんの複合体を形成する。最適な粒子径となり、高次構造を取るために、自然免疫応答を強く活性化することが可能となる |
|
研究チームはまず、核酸医薬として期待されているCpG ODN「K3」と多糖「βグルカン」との複合体「K3-SPG」を作製し、ヒト細胞で自然免疫を活性化するかどうかの検討を行った。その結果、これまでに報告されているCpG ODNに比べて、強く自然免疫応答を活性化していることが判明したのである。
次に、マウスインフルエンザワクチンモデルを用いて検討したところ、季節性インフルエンザワクチンとして用いられている「スプリットワクチン」にK3-SPGを添加するだけで、これまで効果が高いと考えられてきた「全粒子ワクチン」よりもインフルエンザウイルス感染に対して強い防御効果を示すことが確認された(画像3)。ヒトへの応用が考慮され、霊長類であるカニクイザルで検討された結果、インフルエンザワクチンに対する免疫応答が強力に誘導されたことから、マウスと霊長類での反応性の違いを克服できたと考えられるという。
なお全粒子ワクチンとは、生きたインフルエンザウイルスに化学的な不活化処理を行い、感染性をなくしたワクチンのことをいう。インフルエンザウイルス由来のRNAが含まれており、このRNAが内因性のアジュバントとして働くことから、現在の予防接種で用いられている「不活化スプリットワクチン」(インフルエンザウイルスの抗原タンパク質のみを精製したワクチン)に比べ、効果が高いことがわかっている。
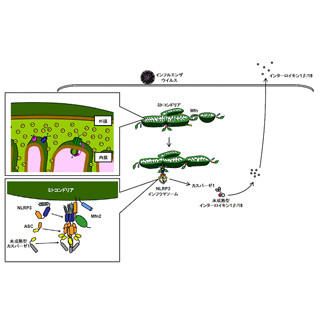
さらにK3-SPGの作用機序、特に体内動態を明らかとするため、イメージング技術を用いた解析が行われた。その結果、K3-SPGはマウスに接種後、ただちにリンパ節表面の細胞(マクロファージ)に特異的に取り込まれることが判明。その後、K3-SPGは異物の存在を教える免疫システムの司令塔である樹状細胞(抗原提示細胞)に取り込まれ、また強く活性化していることも明らかとなった(画像4)。

|

|
|
画像3(左):インフルエンザワクチンアジュバントとしてのK3-SPG。従来の不活化全粒子ワクチンは、スプリットワクチンに比べて効果が高いとされているが、不活化全粒子ワクチン接種時でも致死量となるウイルス感染において、新規アジュバントをスプリットワクチンに加えることで、100%の生存率が示された。画像4(右):新規アジュバントK3-SPGの生体内における作用機序 |
|
これらの結果から、新規免疫核酸医薬であるK3-SPGはマウスだけでなく、霊長類であるカニクイザルにおいてもアジュバントとして有用であることが示唆されると共に、ヒト細胞を用いた結果からも、ヒトへの応用が可能であると見込まれるという。
今回の研究により、ワクチンアジュバントとして新規核酸医薬の開発に成功した形だ。この新規アジュバントはマウスやカニクイザルだけでなく、ヒト細胞においても従来のCpG ODNより強い、自然免疫や獲得免疫の活性化を示した点が特徴である。
研究チームは今後、この新規アジュバントを実際にヒトへ応用するために、GMP準拠の製剤化を行うことが次の課題であると考えているという。この新規アジュバントの製剤化に成功すれば、インフルエンザワクチンのアジュバントや、がんワクチンやほかの感染症のワクチンへの応用も可能であり、新規ワクチンまたは治療法の開発が期待されるとしている。